题目内容
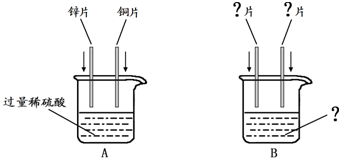
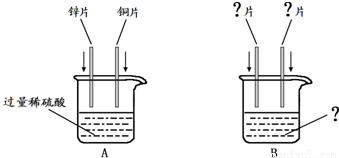
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )
A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
A
解析:在原电池电子是从负极经导线传递到正极上,电流的方向和电子的流向正好相反。根据装置图可判断c是负极,d是正极。锌比铜活泼,所以锌是负极,铜是正极。锌所失去的电子通过导线传递到正极上,溶液中的氢离子向正极移动,在正极上得到电子,被还原生成氢气。所以答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )
| A.d为负极,发生氧化反应 |
| B.c为锌片,电池工作时,溶液中SO42-向c移动 |
| C.电池工作的过程中,d电极上产生大量的气泡 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |