网址:http://m.1010jiajiao.com/timu3_id_87314[举报]

(1)写出甲池中正极的电极反应式:____________________________________________。
(2)写出乙池中负极的电极反应式:____________________________________________。
总反应的离子方程式为_____________________________________________________。
(3)如果甲与乙同学认为“构成原电池的材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_________活泼性更强,而乙会判断出_________活泼性更强(写元素符号)
(4)由实验,可得到如下哪些正确的结论( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验证明金属活动顺序表已过时,没有实用价值
D.该实验说明化学研究对象复杂,反应条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这一种做法_________(填“可靠”或“不可靠”)。如不可靠,提出另一个判断原电池正负极的可行实验方案____________________________________________________________________(如可靠,可不填写)。
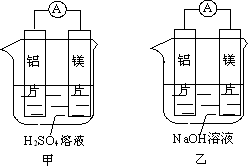
查看习题详情和答案>>有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
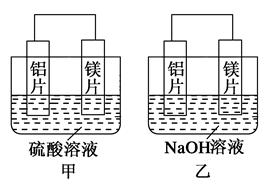
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
| |||||||||||||||||||||||||||||||

(1)写出甲池中正极的电极反应式:
正极:______________ 。?
(2)写出乙池中负极的电极反应式和总反应的离子方程式:?
负极:______________。?
总反应的离子方程式:______________。?
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_______活动性更强,而乙会判断出_______活动性更强。(填写元素符号)?
(4)由此实验,可得到正确的结论是( )?
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质?
B.镁的金属性不一定比铝的金属性强?
C.该实验说明金属活动顺序表已过时,已没有实用价值?
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析?
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法_______(填“可靠”或“不可靠”)。(如不可靠,请提出另一个判断原电池正负极的可行实验方案;如可靠,此问可不回答)
查看习题详情和答案>>