摘要:12.已知25 ℃时.电离常数Ka(HF)=3.6×10-4 mol/L.溶度积常数Ksp(CaF2)=1.46×10-10.现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液.则下列说法中.正确的是( ) A.25 ℃时.0.1 mol/L HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中.Ksp(CaF2)= D.该体系中有CaF2沉淀产生 [解析] A项中由于HF为弱酸.故[H+]<0.1 mol/L.pH>1,B项中Ksp(CaF2)只与温度有关.与浓度无关,C项中Ksp(CaF2)与Ka(HF)不存在倒数关系.根据Ka(HF)=3.6×10-4得[H+]=[F-]==6×10-2mol/L [Ca2+]==0.1 mol/L Qc(CaF2)=0.1 mol/L×(6×10-2)2 mol2/L2≥Ksp(CaF2)=1.46×10-10 所以该体系中有CaF2沉淀产生.D对. [答案] D
网址:http://m.1010jiajiao.com/timu3_id_87127[举报]
(2011?青岛模拟)已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L 0.2mol?L-1HF溶液中加入1L 0.2mol?L-1CaCl2溶液,则下列说法中,正确的是( )
查看习题详情和答案>>
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L0.2mol?L-1HF溶液中加入1L0.2mol?L-1CaCl2溶液,则下列说法中正确的是( )
(2008?龙湖区模拟)已知25℃时,电离常数Ka(HF)=3.6×10-4 mol?L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3?L-3.现向1L0.2mol?L-1HF溶液中加入1L0.2mol?L-1CaCl2溶液,则下列说法中,正确的是( )
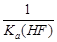 D.KSP(CaF2)随温度和浓度的变化而变化
D.KSP(CaF2)随温度和浓度的变化而变化