摘要:0.004 mol 0.004 mol 0.004 mol 0.004 mol 可知溶于水后.溶液中的溶质为CH3COOH 0.004 mol.NaCl0.004 mol.CH3COONa 0.006 mol. (1)溶液中的微粒有:H2O.CH3COOH.Na+.Cl-.CH3COO-.H+.OH-共7种. (2)据物料守恒有: n(CH3COO-)+n(CH3COOH)=0.010 mol (3)据电荷守恒有: n(Na+)+n(H+)=n(CH3COO-)+n(Cl-)+n(OH-) 则:n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010 mol-0.004 mol=0.006 mol [答案] CH3COO- CH3COOH (3)0.006
网址:http://m.1010jiajiao.com/timu3_id_87113[举报]
(1)在25 ℃时,1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,c(N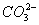 )由小到大的顺序是______________________。
)由小到大的顺序是______________________。
(2)用物质的量都是0.1 mol的CH3COOH和CH3COONa在常温下配成1 L混合溶液,已知其中的c(CH3COO-)>c(Na+),则对该混合溶液的下列判断中正确的是( )
①c(H+)>c(OH-) ②c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1 ③c(CH3COO-)<c(CH3COOH)
④c(CH3COOH)+c(OH-)=0.1 mol·L-1
A.只有② B.①和② C.①②③ D.全部正确
(3)向碳酸钠溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中碳酸氢根离子浓度变化趋势可能是:
A.逐渐减小 B.逐渐增大 C.先逐渐增大而后减小 D.先逐渐减小而后增大
你的选择是______(填正确选项标号),试用化学方程式和简要文字说明理由__________。
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①溶液中共有_______种粒子(包括分子和离子);
②溶液中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和_________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。
查看习题详情和答案>>