摘要:13.现有25 ℃时.0.1 mol/L的氨水.请回答以下问题: (1)若向氨水中加入少量硫酸铵固体.此时溶液中 (填“增大 .“减小 或“不变 ). (2)若向氨水中加入稀硫酸.使其恰好完全中和.写出反应的离子方程式 , 所得溶液的pH 7(填“> .“< 或“= ).用离子方程式表示其原因 . 溶液中各离子物质的量浓度由大到小的顺序为 . (3)若向氨水中加入稀硫酸至溶液的pH=7.此时[NH4+]=a mol/L.则[SO42-]= . [解析] (1)加入NH4+会抑制NH3·H2O的电离.使[NH3·H2O]变大.[OH-]变小. (2)恰好中和时.溶质为(NH4)2SO4.NH4+水解使溶液显酸性. (3)根据电荷守恒[NH4+]+[H+]=2[SO42-]+[OH-].因pH=7.所以有[H+]=[OH-].即[SO42-]=[NH4+]= mol·L-1. [答案] (1)减小 (2)NH3·H2O+H+===NH4++H2O < NH4++H2ONH3·H2O+H+ [NH4+]>[SO42-]>[H+]>[OH-] (3) mol/L
网址:http://m.1010jiajiao.com/timu3_id_87079[举报]
有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[c(H+)/c(OH-)]。现有25 ℃时,0.1 mol·L-1的二元酸H2A溶液的AG=6.0,则下列说法正确的是
A.在Na2A、NaHA两溶液中,前者所含微粒种类多
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数近似相等
C.某NaOH溶液与H2A溶液等体积混合后,其AG的值一定小于零
D.在25 ℃时,溶液的pH与AG的换算公式为pH=7-![]() AG
AG
现有25℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中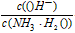 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式__________________;所得溶液的pH_______7(填“<”“>”或“=”), 用离子方程式表示其原因__________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=_____________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
查看习题详情和答案>>
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
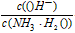 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式__________________;所得溶液的pH_______7(填“<”“>”或“=”), 用离子方程式表示其原因__________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=_____________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
现有25℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中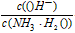 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式__________________;所得溶液的pH_______7(填“<”“>”或“=”), 用离子方程式表示其原因__________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=_____________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
查看习题详情和答案>>
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
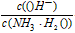 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式__________________;所得溶液的pH_______7(填“<”“>”或“=”), 用离子方程式表示其原因__________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=_____________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
已知25 ℃ 时,0.1 mol·L-1的氨水中NH3·H2O的电离程度和0.1 mol·L-1的醋酸溶液中醋酸的电离程度大致相当。现有25 ℃ 时0.1 mol·L-1的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体并使之溶解后发现溶液的pH增大。对此现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。?
(1)为验证上述哪种解释正确,同学们设计了一个探讨性实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质? ?(填字母),然后测定溶液的pH。?
A.固体NaOH
B.固体CH3COONH4?
C.NH3
D.固体NaHCO3?
(2)如果甲同学的解释正确,则实验后溶液的pH应 (填“增大”“减小”或“不变”)。如果乙同学的解释正确,则实验后溶液的pH应 (填“增大”“减小”或“?不变?”)。(3)根据中学所学化学知识,你认为上述两种解释中 (填“甲”或“乙”)正确,简述理由: 。
查看习题详情和答案>>
已知25℃时,0.1mol/L氨水和0.1mol/L醋酸溶液的电离常数约相等:K(NH3?H2O)=K(CH3COOH)=1.75×10-5;醋酸钠中的醋酸根离子能发生水解反应:CH3COO-+H2O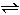 CH3COOH+OH-而使溶液呈碱性。
CH3COOH+OH-而使溶液呈碱性。
现有25℃时的0.1mol/L醋酸溶液,其pH约为3,向其中加入少量醋酸钠晶体并使之溶解后,发现溶液的pH增大。对此,有两种不同的解释:
甲同学认为,醋酸钠水解后呈碱性,增大了c(OH-),故而溶液的pH增大;
乙同学认为,醋酸钠溶于水后电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,故而溶液的pH增大。
(1)根据中学所学知识,你认为上述解释中哪一种正确?简述你的理由。
(2)请从固体NaOH、固体NaHCO3、固体CH3COONH4、固体NH4Cl中选择一种试剂,设计一个简单的实验,用以证明上述哪种解释合理。 查看习题详情和答案>>
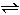 CH3COOH+OH-而使溶液呈碱性。
CH3COOH+OH-而使溶液呈碱性。现有25℃时的0.1mol/L醋酸溶液,其pH约为3,向其中加入少量醋酸钠晶体并使之溶解后,发现溶液的pH增大。对此,有两种不同的解释:
甲同学认为,醋酸钠水解后呈碱性,增大了c(OH-),故而溶液的pH增大;
乙同学认为,醋酸钠溶于水后电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,故而溶液的pH增大。
(1)根据中学所学知识,你认为上述解释中哪一种正确?简述你的理由。
(2)请从固体NaOH、固体NaHCO3、固体CH3COONH4、固体NH4Cl中选择一种试剂,设计一个简单的实验,用以证明上述哪种解释合理。 查看习题详情和答案>>