题目内容
已知(1)为验证上述哪种解释正确,同学们设计了一个探讨性实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质? ?(填字母),然后测定溶液的pH。?
A.固体NaOH
B.固体CH3COONH4?
C.NH3
D.固体NaHCO3?
(2)如果甲同学的解释正确,则实验后溶液的pH应 (填“增大”“减小”或“不变”)。如果乙同学的解释正确,则实验后溶液的pH应 (填“增大”“减小”或“?不变?”)。(3)根据中学所学化学知识,你认为上述两种解释中 (填“甲”或“乙”)正确,简述理由: 。
(1)B (2)不变 增大 (3)乙 在醋酸溶液中存在着电离平衡CH3COOH![]() CH3COO-+ H+ ,向其中加入CH3COONa晶体后,体系中的c(CH3COO-)增大,使电离平衡向左移动,导致溶液中c(H+)减小,故溶液的pH增大??
CH3COO-+ H+ ,向其中加入CH3COONa晶体后,体系中的c(CH3COO-)增大,使电离平衡向左移动,导致溶液中c(H+)减小,故溶液的pH增大??
解析:在醋酸溶液中存在着电离平衡:CH3COOH![]() CH3COO-+ H+ 。当向其中加入CH3COONa晶体后,晶体溶解后,完全电离出CH3COO-,c(CH3COO-)增大,使电离平衡向左移动,导致溶液中?c(H+)?减小,故溶液的pH增大;另一方面CH3COO-发生水解,但程度较小,针对上述的影响程度,这点可以忽略不计。亦即CH3COONa电离出的CH3COO-对醋酸的电离的抑制作用占主导地位。为证明上述解释的正确性可选择溶于水呈中性的醋酸盐,根据题中所给条件,应选择CH3COONH4晶体。
CH3COO-+ H+ 。当向其中加入CH3COONa晶体后,晶体溶解后,完全电离出CH3COO-,c(CH3COO-)增大,使电离平衡向左移动,导致溶液中?c(H+)?减小,故溶液的pH增大;另一方面CH3COO-发生水解,但程度较小,针对上述的影响程度,这点可以忽略不计。亦即CH3COONa电离出的CH3COO-对醋酸的电离的抑制作用占主导地位。为证明上述解释的正确性可选择溶于水呈中性的醋酸盐,根据题中所给条件,应选择CH3COONH4晶体。

练习册系列答案
相关题目
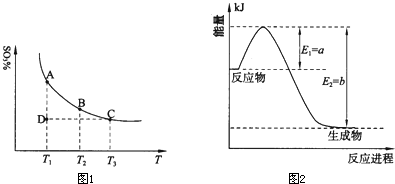

 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: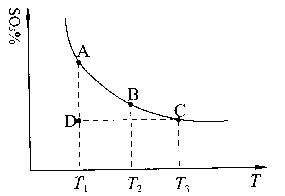

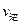 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) )
)