摘要:3.下列实验仪器在实验前.应特别注意是否漏液的是( ) ①碱式滴定管.②普通漏斗.③分液漏斗.④蒸馏烧瓶.⑤容量瓶.⑥酸式滴定管. A.③⑤⑥ B.①③⑤⑥ C.①③④⑤⑥ D.①②③④⑤⑥ [解析] 带有活塞的容器.玻璃接口处易于漏水.使用前必须进行检验操作. [答案] B
网址:http://m.1010jiajiao.com/timu3_id_86847[举报]
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
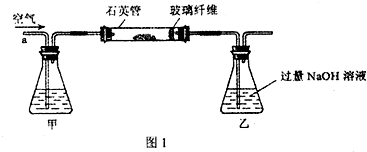
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
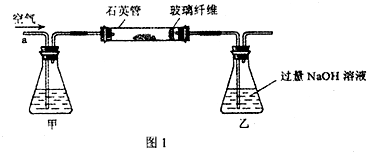
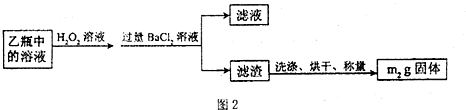
II.反应结束后,将乙瓶中的溶液进行如图2处理.
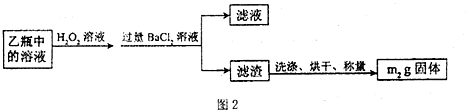
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是
(2)I中,甲瓶内所盛试剂是
(3)II中的滤渣在称量前还应进行的操作是
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有
(5)该黄铁矿中硫元素的质量分数
×100%
×100%(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数
×100%
×100%(用I、II中有关实验数据表达)
查看习题详情和答案>>
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.

[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是
FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g)△H=-853kJ/mol
| 11 |
| 4 |
| 1 |
| 2 |
FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g)△H=-853kJ/mol
.| 11 |
| 4 |
| 1 |
| 2 |
(2)I中,甲瓶内所盛试剂是
NaOH
NaOH
溶液;乙瓶内发生反应的离子方程式有2OH-+SO2═SO32-+H2O
2OH-+SO2═SO32-+H2O
;I中玻璃纤维的作用是防止粉尘进入导管和乙装置
防止粉尘进入导管和乙装置
.(3)II中的滤渣在称量前还应进行的操作是
洗涤、干燥
洗涤、干燥
;II中,所加H2O2溶液需足量的理由是使SO32- 完全转化成SO42-
使SO32- 完全转化成SO42-
.(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有
250ml容量瓶
250ml容量瓶
;④中取稀释液25.00mL需用的仪器是酸式滴定管
酸式滴定管
.(5)该黄铁矿中硫元素的质量分数
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |
阅读分析材料,据此完成下列要求。
工业纯碱中常含有少量的NaCl和NaOH。某校课外活动小组的同学为测定纯碱样品中
Na2CO3的质量分数,选择下列适当装置进行连接,并对设计方案不断完善,成功完成了
测定实验。
 |
⑴活动小组的五位同学对实验装置的设计进行了讨论发言,内容如下:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,分别测量反应前和反应后E的总质量,就可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置 (填序号),其目的是 。
丙:应该用B装置取代A装置。从B装置的导管口处缓慢鼓入空气,其目的是 。
丁:若直接向B装置中鼓入空气会导致实验测定结果 (填“偏高”、“偏低”或
“无影响”),因此,应将鼓入的空气先通过装置 (填序号)。
戊:E装置后还应连接装置F,其作用是 。
⑵学生课外活动小组测定的数据如下,计算该工业纯碱中Na2CO3的质量分数为 。
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 6.4g | 51.9g | 54.1g |
⑶简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象) 。
查看习题详情和答案>>黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
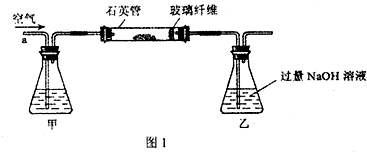
II.反应结束后,将乙瓶中的溶液进行如图2处理.
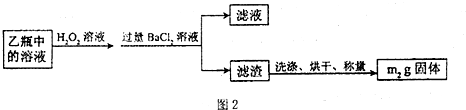
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)
查看习题详情和答案>>
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.

[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)
查看习题详情和答案>>
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.

[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)
查看习题详情和答案>>
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
II.反应结束后,将乙瓶中的溶液进行如图2处理.
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)
查看习题详情和答案>>
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.

[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是______.
(2)I中,甲瓶内所盛试剂是______溶液;乙瓶内发生反应的离子方程式有______;I中玻璃纤维的作用是______.
(3)II中的滤渣在称量前还应进行的操作是______;II中,所加H2O2溶液需足量的理由是______.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有______;④中取稀释液25.00mL需用的仪器是______.
(5)该黄铁矿中硫元素的质量分数______(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数______(用I、II中有关实验数据表达)