网址:http://m.1010jiajiao.com/timu3_id_86810[举报]
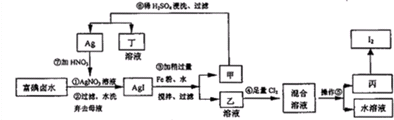
(1)步骤③加Fe粉的目的是
(2)写出步骤④中反应的离子方程式
(3)上述生产流程中,可以循环利用的副产物是
(4)操作⑤的名称是
完成下列问题:
(1)写出乙、丁中溶质的化学式:乙______________,丁______________。
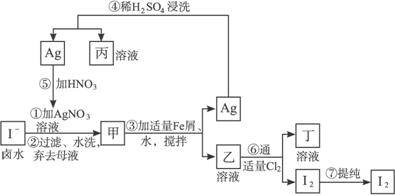
图4-2
(2)第④步操作中用稀H2SO4浸洗的目的是( )
A.除去未反应的![]() B.除去未反应的I-
B.除去未反应的I-
C.除去未反应的Fe D.除去碱性物质
(3)第⑦步操作可供提纯I2的一种方法是__________________________(只填名称)。
查看习题详情和答案>>
(1)写出乙、丁中溶质的化学式:乙_________________,丁_________________。
(2)第④步操作中用稀H2SO4浸洗的目的是_________________ (填写字母编号)。
A.除去未反应的NO B.除去未反应的I-
C.除去未反应的Fe D.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是____________和_____________。(不要写具体步骤)
(4)实验室检验I2的方法是___________________________________________________。
(5)甲物质见光易变黑,其原因是________________________________(用化学方程式表示)。
查看习题详情和答案>>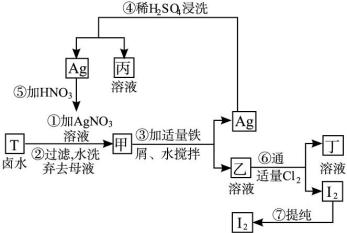
(1)写出乙、丁中溶质的化学式:乙___________,丁___________。
(2)第④步操作中用稀硫酸浸洗的目的是___________。
a.除去未反应的![]()
b.除去未反应的I-
c.除去未反应的Fe
d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是___________和___________(不要求写具体步骤)。
(4)实验室检验I2的方法是_________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示):______________________。
(提示:3Ag+4HNO3====3AgNO3+NO↑+2H2O)
(6)按上述实验过程填空:
写出①②③反应的化学方程式。
①___________________________________;
②___________________________________;
③___________________________________。
查看习题详情和答案>>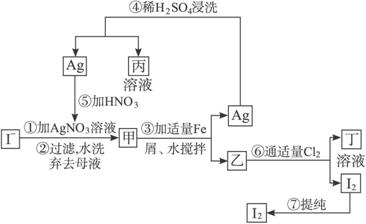
试完成下列问题:
(1)乙、丁中溶质的化学式:乙_______________,丁_______________。?
(2)第④步操作中用稀H2SO4浸洗的目的是_______________(填字母编号)。
A.除去未反应的![]() B.除去未反应的I-
B.除去未反应的I-
C.除去未反应的Fe D.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是_____________和_____________(不要求写具体步骤)。
(4)实验室检验I2的方法是________________________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)____________________________。
查看习题详情和答案>>