题目内容
 甲酸甲酯水解反应方程式为:HCOOCH3+H2O?HCOOH+CH3OH-Q(Q>0)
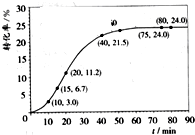
甲酸甲酯水解反应方程式为:HCOOCH3+H2O?HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
(2)计算15~20min范围内:甲酸甲酯的减少量为
0.045
0.045
mol,甲酸甲酯的平均反应速率为0.009
0.009
mol/min;80~90min范围内甲酸甲酯的平均反应速率为0
0
mol/min.(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因:
该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大
该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大
.(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
分析:(1)学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由图表可知,15min时,甲酸甲酯的转化率为6.7%;20min时,甲酸甲酯的转化率为11.2%,两次时刻剩余的甲酸甲酯的物质的量之差,即为15~20min范围内甲酸甲酯的减少量;
根据题目图表可知反应速率为单位时间内物质的量的变化,15~20min范围内甲酸甲酯的平均速率为
,据此求解;
由图可知,80~90min常用平衡转化,甲酸甲酯的物质的量变化为0;
(3)甲酸具有催化作用,加快反应,由图中数据可知,开始氢离子浓度小,催化效果不明显,随着反应进行氢离子浓度增大,催化效果明显,甲酸增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,当达到平衡时,反应速率几乎不变;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,又该反应是吸热反应,升高温度平衡向逆反应方向移动,甲酸甲酯的转化率减小.
(2)由图表可知,15min时,甲酸甲酯的转化率为6.7%;20min时,甲酸甲酯的转化率为11.2%,两次时刻剩余的甲酸甲酯的物质的量之差,即为15~20min范围内甲酸甲酯的减少量;
根据题目图表可知反应速率为单位时间内物质的量的变化,15~20min范围内甲酸甲酯的平均速率为
| △n |
| △t |
由图可知,80~90min常用平衡转化,甲酸甲酯的物质的量变化为0;
(3)甲酸具有催化作用,加快反应,由图中数据可知,开始氢离子浓度小,催化效果不明显,随着反应进行氢离子浓度增大,催化效果明显,甲酸增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,当达到平衡时,反应速率几乎不变;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,又该反应是吸热反应,升高温度平衡向逆反应方向移动,甲酸甲酯的转化率减小.
解答:解:(1)HCOOCH3+H2O?HCOOH+CH3OH的平衡常数表达式k=
,
故答案为:
;
(2)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%=0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%=0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol÷5min=0.009mol?min-1.
由图可知,80~90min常用平衡转化,甲酸甲酯的物质的量变化为0,反应速率为0;
故答案为:0.04;0.009;0;
(3)从图中转化率不难看出,平均速率的变化随转化率的增大先增大再减小,后保持不变.因为反应开始甲酸甲酯的浓度大,所以反应速率较大,后随着反应进行甲酸甲酯的浓度减小,反应速率减小,当达到平衡时,反应速率几乎不变,故反应在10min后反应速率迅速加快的原因为:该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大,
故答案为:该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率增大,所以绘图时要注意T2达到平衡时的平台要高于T1,
故答案为: .
.
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
故答案为:
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
(2)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%=0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%=0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol÷5min=0.009mol?min-1.
由图可知,80~90min常用平衡转化,甲酸甲酯的物质的量变化为0,反应速率为0;
故答案为:0.04;0.009;0;
(3)从图中转化率不难看出,平均速率的变化随转化率的增大先增大再减小,后保持不变.因为反应开始甲酸甲酯的浓度大,所以反应速率较大,后随着反应进行甲酸甲酯的浓度减小,反应速率减小,当达到平衡时,反应速率几乎不变,故反应在10min后反应速率迅速加快的原因为:该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大,
故答案为:该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率增大,所以绘图时要注意T2达到平衡时的平台要高于T1,
故答案为:
 .
.点评:本题考查考生对化学反应速率概念,化学平衡的了解及其影响因素的理解,对化学平衡常数简单计算的掌握,注重考查学生知识迁移、读图及表达能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
(2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是