网址:http://m.1010jiajiao.com/timu3_id_8644[举报]
(7分)小马同学对蛋壳(蛋壳的主要成分是碳酸钙)开展了有关探究.过程如下:将7.5克的蛋壳放入容器中,往其中加入足量的稀盐酸,充分反应,收集到CO2气体体积1.1L(CO2的密度为2g/L).【假设二氧化碳全部是由蛋壳中的碳酸钙与盐酸反应产生,蛋壳的其它物质不与稀盐酸反应.】
以下是小马同学的部分实验报告:
计算参加反应的盐酸质量为多少克?计算过程如下:
解:设参加反应的盐酸质量为x.
CaCO3+HCl=CaCl2+H2O+CO2↑
36.5 28
x 1.1L
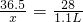
x=3g
答:参加反应的盐酸质量为3g.
请回答下列问题:
(1)小马的计算过程中出现多处错误,请你列出其中的两处错误:
Ⅰ:________;Ⅱ:________.
(2)请你根据小马的实验数据计算这些蛋壳中碳酸钙的质量分数.(写出计算过程)
查看习题详情和答案>>
解决问题常面临着方法的选择,面对不同的结果我们应继续探索。为得知15.8 g高锰酸钾完全分解能产生多少克氧气,小柯与小妍分别采取了以下方法:
小柯:实验测定法 | 小妍:计算法 |
小柯在老师的指导下,将15.8g高锰酸钾充分加热,得到氧气1300mL。 | 解:高锰酸钾中氧元素的质量分数
= 氧气的质量为:15.8g×40.5%=6.4g 答:15.8g高锰酸钾完全分解产生氧气6.4g。 |
请回答:
(1)在本实验条件下,氧气的密度为1.4×10-3g/mL,则由小柯的测量结果可算出
15.8 g高锰酸钾分解后所产生的氧气质量为——g(结果保留一位小数)。
(2)大家经过讨论,认为小妍的计算方法明显错误,本题不能采用该方法计算氧气质量的一项理由是( )。
A.高锰酸钾中含氧元素
B.锰酸钾和二氧化锰中含氧元素
C.氧气中含氧元素
(3)请计算15.8 g高锰酸钾完全分解所产生的氧气质量为____________________g。
(4)若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,
请提出一种合理的猜测:_______________________________。
查看习题详情和答案>>请参照情景一的编题方式,为情景二编写计算题,并为两题求解。

(1)情景一:已知某种溶质的质量,把它配制成一定溶质质量分数的溶液。
![]() 题目:小刚用15 g NaCl晶体配制溶质质量分数为15%的NaCl溶液,需要加水的质量是多少? 解:________________。
题目:小刚用15 g NaCl晶体配制溶质质量分数为15%的NaCl溶液,需要加水的质量是多少? 解:________________。
(2)情景二:配制某种溶质的一定溶质质量分数、一定质量的溶液。
题目:______________。 解:________________。
![]()
 缺铁性贫血是由于人体内缺少铁元素而影响血红蛋白合成所引起的一种常见的贫血症,患者在补充铁元素时要注意科学补充.如图是某品牌补铁剂的标签,其中服用剂量被污损,根据医生建议患者每天应补充铁元素150~200mg,请你计算服用此补铁剂的正确剂量为(按每日服用1次计算)( )
缺铁性贫血是由于人体内缺少铁元素而影响血红蛋白合成所引起的一种常见的贫血症,患者在补充铁元素时要注意科学补充.如图是某品牌补铁剂的标签,其中服用剂量被污损,根据医生建议患者每天应补充铁元素150~200mg,请你计算服用此补铁剂的正确剂量为(按每日服用1次计算)( )(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.

①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为
| ||
| ||
③在f处点燃气体的目的是
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
| 编号 | 称量物 | 反应前 | 反映后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x
3CO+Fe2O3
| ||
160 132
x 6.6g
| 160 |
| 132 |
| X |
| 6.6g |
样品中氧化铁的质量分数为
| 8g |
| 10g |
答:样品中氧化铁的质量分数为80%
3CO+Fe2O3
| ||
160 132
x 6.6g
| 160 |
| 132 |
| X |
| 6.6g |
样品中氧化铁的质量分数为
| 8g |
| 10g |
答:样品中氧化铁的质量分数为80%
 ×100%
×100%