摘要:3.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.二者在自然界中共生.根据题意完成下列填空: (1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应.As2S3和SnCl2的物质的量之比为 . (2)上述反应中的氧化剂是 .反应产生的气体可用 吸收. (3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3-=2H3AsO4+ 3S+10NO2↑+ 2H2O 若生成2mol H3AsO4.则反应中转移电子的物质的量为 .若将该反应设计成一原电池.则NO2应该在 附近逸出. (4)若反应产物NO2与11.2L O2混合后用水吸收全部转化成浓HNO3.然后与过量的碳反应.所产生的CO2的量 . a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定 解析:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子.而1molSnCl2作还原剂失去2mol电子.所以二者的物质的量之比是1:1,(2)H2S是还原性气体可用碱液吸收或硫酸铜溶液吸收,(3)As2S3作还原剂.转移电子的个数是2×=10.NO2属于还原产物.在正极生成,(4)根据电子守恒可知生成CO2的量是0.5mol×4/4=0.5mol.但考虑到随着反应到进行.硝酸的浓度会降低而稀硝酸不与碳反应. 答案:(1)1:1 (2)As2S3 氢氧化钠溶液或硫酸铜溶液 (3)10mol 正极 (4)a
网址:http://m.1010jiajiao.com/timu3_id_86262[举报]
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,写出As2S3和SnCl2反应的化学方程式,并用双线桥标出电子转移的方向和数目
 .
.
(2)上述反应中的氧化剂是
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-═2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
查看习题详情和答案>>
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,写出As2S3和SnCl2反应的化学方程式,并用双线桥标出电子转移的方向和数目


(2)上述反应中的氧化剂是
As2S3
As2S3
,反应产生的气体可用氢氧化钠溶液或硫酸铜溶液
氢氧化钠溶液或硫酸铜溶液
吸收.(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-═2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为
10mol
10mol
.若将该反应设计成一原电池,则NO2应该在正极
正极
(填“正极”或“负极”)附近逸出.(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
a
a
(选填编号).a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
(2011?上海)雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为
(2)上述反应中的氧化剂是
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
查看习题详情和答案>>
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为
1:1
1:1
.(2)上述反应中的氧化剂是
As2S3
As2S3
,反应产生的气体可用氢氧化钠溶液或硫酸铜溶液
氢氧化钠溶液或硫酸铜溶液
吸收.(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为
10mol
10mol
.若将该反应设计成一原电池,则NO2应该在正极
正极
(填“正极”或“负极”)附近逸出.(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
a
a
(选填编号).a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为
(2)上述反应中的氧化剂是
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
(信息:碳粉与浓硝酸反应:C+4HNO3(浓)═CO2↑+4NO2↑+2H2O )
查看习题详情和答案>>
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为
1:1
1:1
.(2)上述反应中的氧化剂是
As2S3
As2S3
,反应产生的气体可用NaOH溶液
NaOH溶液
吸收.(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为
10mol
10mol
.(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量
A
A
(选填编号).A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
(信息:碳粉与浓硝酸反应:C+4HNO3(浓)═CO2↑+4NO2↑+2H2O )
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.写出此反应的化学方程式
(2)上述反应中的氧化剂是
(3)As2S3和HNO3有如下反应:As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O 若生成1mol H3AsO4,则反应中转移电子的物质的量为
(4)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4g铜被氧化,参加反应的HNO3的质量是
(5)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol Cr2O72-反应所需PbO2的物质的量为
查看习题详情和答案>>
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.写出此反应的化学方程式
2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑
2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑
.(2)上述反应中的氧化剂是
As2S3
As2S3
,氧化产物是SnCl4
SnCl4
.(3)As2S3和HNO3有如下反应:As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O 若生成1mol H3AsO4,则反应中转移电子的物质的量为
5mol
5mol
.(4)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4g铜被氧化,参加反应的HNO3的质量是
16.8
16.8
g,被还原的HNO3的质量是4.2
4.2
g.(5)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol Cr2O72-反应所需PbO2的物质的量为
3mol
3mol
.
硫单质及其化合物在工农业生产中有着重要的应用.
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
Sx(s)△H=a kJ/mol
2COS(g)+SO2(g)=2CO2(g)+
Sx(s)△H=b kJ/mol.
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为 .
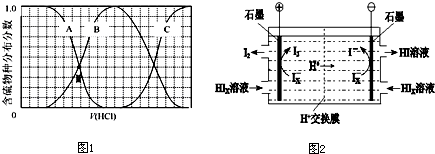
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示 .
②滴加过程中,溶液中微粒浓度大小关系,正确的是 (填字母).
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为 .
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:
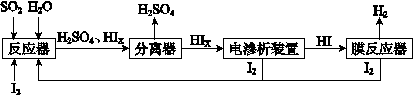
①写出反应器中发生反应的化学方程式是 .
②电渗析装置如图2所示,写出阳极的电极反应式 .该装置中发生的总反应的化学方程式是 .
查看习题详情和答案>>

(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+
| 1 |
| x |
2COS(g)+SO2(g)=2CO2(g)+
| 3 |
| x |
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,当生成H3AsO4的物质的量为0.6mol反应中转移电子的数目为
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
①B表示
②滴加过程中,溶液中微粒浓度大小关系,正确的是
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下所示:

①写出反应器中发生反应的化学方程式是
②电渗析装置如图2所示,写出阳极的电极反应式