网址:http://m.1010jiajiao.com/timu3_id_85950[举报]
(1)工业上得到单质X的冶炼方法1是
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3反应的化学方程式是
| ||
| ||
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式
(4)若试剂2是盐酸.
①如何检验D物质中的金属阳离子
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因

请回答下列问题:
(1)写出X与A反应的化学方程式:
| ||
| ||
(2)若试剂1是NaOH溶液,写出X与试剂1反应的离子方程式
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
②将物质C溶于水,其溶液呈酸性,原因是
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以D、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(4)若试剂1和试剂2均是稀盐酸,将C与D混合后,通入气体Z,再滴加氢氧化钠溶液调节溶液的pH,可水解聚合得到高效净水剂聚合氯化铝铁[AlFe(OH)nCl6-n]m.气体Z是

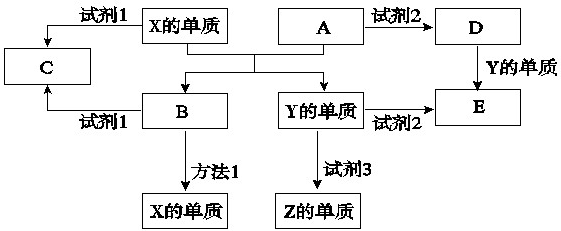
回答下列问题:
(1)X的单质与A反应的化学方程式是
| ||
| ||
(2)若C溶液显碱性,则试剂1是
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是
②写出D-E反应的离子方程式
③某高效净水剂是由Y(OH)SO4聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平):
(16分)A、B、C、D、E是中学常见的五种物质,其转化关系如下图示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是单质,C、E是化合物。
(1)若A是单质,其水溶液具有漂白性,D在常温下为固态,且A、D均可使湿润的淀粉碘化钾试纸变蓝。E是一种可溶性强碱,其焰色反应为黄色。
①E的电子式为 ;C固态时的晶体类型为 ;
②写出反应II的离子方程式 ;
③在E的环境中,A与B还可以发生另外一个反应,每1mol B完全反应转移6 mol电子,写出反应的化学方程式 。
(2)若B是单质,工业上用电解氧化物的方法获得B。B元素原子的电子层数等于其最外层电子数。D是无色无味的气体,E是B的最高价氧化物的水化物。
①若C溶液显酸性,其原因用离子方程式表示为 ;
②若C溶液显碱性,则反应II的离子方程式为 。
查看习题详情和答案>>
(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
回答下列问题:
(1)X的单质与A反应的化学方程式是 。
(2)若C溶液显碱性,则试剂1是 液溶(写化学式):若C溶液显酸性,则显酸性的原因是(用离子方程式表示) 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 ;
②写出D→E反应的离子方程式 ;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是(不必配平): [来源: 。
查看习题详情和答案>>