网址:http://m.1010jiajiao.com/timu3_id_85852[举报]
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
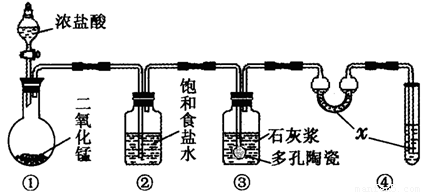
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
|
滴定次数 |
1 |
2 |
3 |
|
KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
查看习题详情和答案>>
已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
(4)将某密度为l.19g·cm-3,质量分数为36.5%的浓盐酸,配制成500mL0.5mol/L的稀盐酸,所需浓盐酸的体积为 。
查看习题详情和答案>>已知乳酸的结构简式为 。试回答:
(1)乳酸分子中含有_______ _和________ _两种官能团(写名称);
(2)乳酸和金属钠反应的化学方程
为 ;
(3)乳酸与NaOH溶液反应的化学方程式为
___________________________________________________________________;
(4)乳酸能与乙醇发生反应生成一种有特殊香味的物质,请写出该反应的方程式:
(5)1 mol乳酸完全燃烧需消耗 mol O2
查看习题详情和答案>>|
下列混合溶液中,各离子浓度的大小顺序正确的是 | |
| [ ] | |
A. |
10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:C(Cl)>C(NH4)>C(OH)>C(H) |
B. |
10 mL 0.1 mol/L NH1Cl与5 mL 0.2 mol/L NaOH两溶液混合:C(Na+)=C(Cl)>C(OH)>C(H+) |
C. |
10 mL 0.1 mol/L醋酸与5 mL 0.2 mol/L NaOH混合:C(Na)=C(CH3COO)>C(OH)>C(H) |
D. |
10 mL 0.5 mol/L CH3COONa溶液与6 mL 0.1 mol/L盐酸混合:C(Cl)>C(Na+)>C(OH)>C(H) |
| |||||||||||||||||||||||||||||||||||||||||||||