摘要:21.已知几种离子的还原能力强弱顺序为I->Fe2+>Br-. (1)向含1 mol FeI2和2 mol FeBr2的溶液中通入3 mol Cl2后.溶液中各种离子的物质的量之比是 (不计H+和OH-). (2)向40 mL FeBr2溶液中通入0.672 L Cl2.充分反应后测得溶液中Cl-和Br-的物质的量浓度相等.求原FeBr2溶液的物质的量浓度(要求写出简单的计算过程). 解析:(1)根据题意知.离子的还原性顺序是I->Fe2+>Br-.故通入氯气时先氧化I-.然后氧化Fe2+.最后才氧化Br-.当通入3 mol Cl2后.先氧化全部I-.Fe2+.最后再氧化1 mol Br-.故溶液中除了H+.OH-外.剩余Br- 3 mol.生成Fe3+3 mol.生成Cl- 6 mol.故n(Fe3+)?n(Br-)?n(Cl-)=1?1?2. (2)n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol 所以n(Cl-)=0.03 mol×2=0.06 mol n(Br-)=0.06 mol 由题意可推知.反应后溶液中的Fe2+全部转化为Fe3+ 由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol 根据铁元素守恒得:n(FeBr2)=n(Fe3+) ∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1. 答案:(1)n(Fe3+)?n(Br-)?n(Cl-)=1?1?2 (2)解:n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol 所以n(Cl-)=0.03 mol×2=0.06 mol n(Br-)=0.06 mol 由题意可推知.反应后溶液中的Fe2+全部转化为Fe3+ 由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol 根据铁元素守恒得:n(FeBr2)=n(Fe3+) ∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1.
网址:http://m.1010jiajiao.com/timu3_id_85826[举报]
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15mol Cl2被还原,则所得溶液中含有的阴离子主要是
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸),试写出此反应的离子方程式:
查看习题详情和答案>>
(1)若氯水中有0.15mol Cl2被还原,则所得溶液中含有的阴离子主要是
Br-、Cl-
Br-、Cl-
,剩余Fe2+的物质的量为0.1mol
0.1mol
.(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为
0.25mol
0.25mol
,若最终所得溶液为400mL,溶液中主要阳离子及其物质的量浓度为0.5mol/L
0.5mol/L
.(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
Cl2>Br2>Fe3+>I2
Cl2>Br2>Fe3+>I2
.(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸),试写出此反应的离子方程式:
5Cl2+I2+6H2O=2 IO3-+12H++10Cl-
5Cl2+I2+6H2O=2 IO3-+12H++10Cl-
,上述所有反应共消耗Cl20.8
0.8
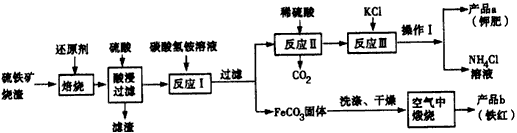
mol.硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红 等产品的流程如下图所示
已知几种盐的溶解度随温度变化的曲线如下图所示
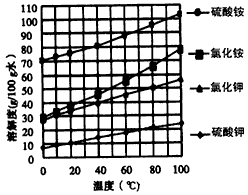
回答下列问题:
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是________ (填字母)。
A.铝 B.镁 C.碳 D.氢气
(2)反应I的反应温度一般需控制在35℃以下,其目的是____________________。
(3)写出反应Ⅲ的离子方程式___________________,操作I是____________。
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为___________________。
(5)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,____________。
查看习题详情和答案>>
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是________ (填字母)。
A.铝 B.镁 C.碳 D.氢气
(2)反应I的反应温度一般需控制在35℃以下,其目的是____________________。
(3)写出反应Ⅲ的离子方程式___________________,操作I是____________。
(4)空气中煅烧FeCO3生成产品b的化学反应方程式为___________________。
(5)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,____________。
(2013?赤坎区模拟)
硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义.利用硫铁矿烧渣制备铁红等产品的实验流程如下:

已知几种盐的溶解度随温度变化的曲线如下图所示:
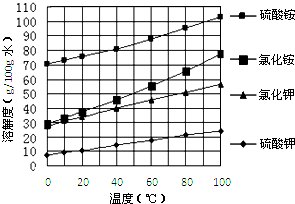
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是
(2)煅烧FeCO3生成产品I的化学反应方程式为
(3)产品Ⅱ的化学式为
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
查看习题详情和答案>>
| ||

已知几种盐的溶解度随温度变化的曲线如下图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是
Fe2+
Fe2+
.(2)煅烧FeCO3生成产品I的化学反应方程式为
4FeCO3+O2
2Fe2O3+4CO2
| ||
4FeCO3+O2
2Fe2O3+4CO2
.实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有
| ||
坩埚、坩埚钳
坩埚、坩埚钳
.(3)产品Ⅱ的化学式为
K2SO4
K2SO4
,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:蒸发结晶、趁热过滤、洗涤、干燥
蒸发结晶、趁热过滤、洗涤、干燥
.(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液
滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液
. 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,1g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
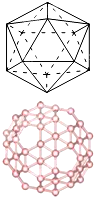
(2)自发现富勒烯C60以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究.C60分子是形如球状的多面体,该结构的建立基于以下考虑:削去右图多面体(含12个顶点,20个正三角形)的每一个顶角,得到由一定数目的正五边形和正六边形所组成的多面体,即为C60分子,该多面体中含有90条棱,且每个碳原子都达到了8电子的稳定结构.已知几种共价键的键能数据如下表:
利用下表数据估算得C60分子的燃烧热为
(120d-60a-30b-60e) kJ?mol-1
(120d-60a-30b-60e) kJ?mol-1
.| 化学键 | C-C | C=C | C≡C | C=O | O=O |
| 键能/(kJ?mol-1) | a | b | c | d | e |
80
80
.
利用储能介质储存太阳能的原理是:白天在太阳光照射下某种固态盐被熔化(实际上是盐溶于自身的结晶水)吸收能量;晚间熔盐释放相应能量而凝固,这样使室温得以调节。
已知几种盐的熔点及其熔化时能量改变值如下所示:
盐 | 熔点/℃ | 质量(g)数值与相对分子质量相等的盐熔化时吸热/kJ |
CaCl2·6H2O | 29.0 | 37.3 |
Na2SO4·10H2O | 32.4 | 77.0 |
Na2HPO4·12H2O | 36.1 | 100.1 |
Na2S2O3·5H2O | 48.5 | 49.7 |
下列有关说法正确的是( )
A.不应选用CaCl2·6H2O
B.可选用Na2SO4·10H2O和Na2HPO4·12H2O
C.最好选用Na2SO4·10H2O,它更加经济
D.以上皆不宜选用
查看习题详情和答案>>