摘要:8.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体.它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF.下列有关说法正确的是( ) A.NF3是氧化剂.H2O是还原剂 B.还原剂与氧化剂的物质的量之比为2:1 C.若生成0.2 mol HNO3.则转移0.2 mol电子 D.NF3在潮湿的空气中泄漏会产生红棕色气体 解析:分析反应前后各元素价态变化.可知NF3在反应中既是氧化剂又是还原剂.其中:NF3→HNO3是被氧化的过程.NF3为还原剂,2NF3→2NO是被还原的过程.NF3是氧化剂.所以还原剂与氧化剂的物质的量之比为1?2.生成1 mol HNO3转移2 mol电子.所以生成0.2 mol HNO3转移0.4 mol电子.NF3与潮湿的空气中的水反应生成NO.NO与空气中的O2反应生成红棕色的NO2.综合上述知选项D正确. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_85322[举报]
三氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O=2NO+HNO3+9HF。下了有关该反应的说法正确的是:
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2mol HNO3,则转移0.2mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
查看习题详情和答案>>
三氟化氮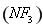 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: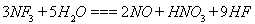 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是
A.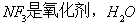 是还原剂
是还原剂
B.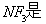 非极性分子,在潮湿空气中泄漏会看到红棕色气体
非极性分子,在潮湿空气中泄漏会看到红棕色气体
C.每消耗0.2mol氧化剂,可收集到5.418L气体
D.若生成1mol 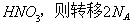 个电子
个电子
查看习题详情和答案>>
(2009?淮安二模)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则其中心离子是
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是
②T元素最可能是
查看习题详情和答案>>
(1)写出制备 NF3的化学反应方程式:
4NH3+3F2=NF3+3NH4F
4NH3+3F2=NF3+3NH4F
.(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
NH3能形成氢键,NF3只有范德华力
NH3能形成氢键,NF3只有范德华力
.(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
.(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则其中心离子是
Al
Al
,配位数为6
6
.(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
R
R
和U
U
.②T元素最可能是
P
P
区元素.若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为平面正三角形
平面正三角形
,其中心原子的杂化方式为sp2
sp2
.(2011?陕西一模)选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是
②T元素最可能是
查看习题详情和答案>>
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:
4NH3+3F2=NF3+3NH4F
4NH3+3F2=NF3+3NH4F
.(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
NH3能形成氢键,NF3只有范德华力
NH3能形成氢键,NF3只有范德华力
.(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
1s22s22p63s23p63d54s1(或[Ar]3d54s1)
1s22s22p63s23p63d54s1(或[Ar]3d54s1)
.(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
Na3AlF6
Na3AlF6
其中心离子是Al
Al
,配位数为6
6
.(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
R
R
和U
U
.②T元素最可能是
P
P
区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形
平面正三角形
,其中心原子的杂化方式为sp2
sp2
.
【化学--选修:物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 .
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 .
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 ,其中心离子是 ,配位数为 .
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是 和 .
②T元素最可能是 区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 .
查看习题详情和答案>>
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列四种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是