摘要:已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g),ΔH=-24.2 kJ/mol.在恒温下.将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中.其中物质的浓度随时间变化的关系如下图所示.下列推理分析合理的是( ) A.前10 min内.用v(NO2)表示的反应速率为0.02 mol/ B.反应进行到10 min时.体系吸收的热量为9.68 kJ C.a.b.c.d四点中v正与v逆均相等 D.25 min时.导致平衡移动的原因是升温 解析:根据反应达平衡后物质的浓度之比.可知初始反应浓度增加的曲线表示NO2变化曲线.前10 min内.v(NO2)=0.04 mol/,反应进行到10 min时.生成NO2 0.8 mol.吸收热量为9.68 kJ,a.b.c.d四点中只有b和d两点位于平衡状态.只有该两点正.逆反应速率相等,25 min时导致平衡移动的原因是增加NO2的浓度.,答案:B
网址:http://m.1010jiajiao.com/timu3_id_85257[举报]
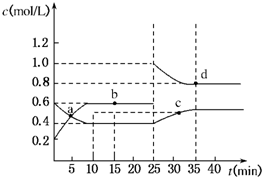 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )| A、反应进行到10 min时,体系吸收的热量为9.68 kJ | B、前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L?min) | C、a、b、c、d四点中v正与v逆均相等 | D、25 min时,导致平衡移动的原因是升温 |
已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。

下列推理分析合理的是
A. 前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B. 反应进行到10 min时,体系吸收的热量为9.68 kJ
C. a、b、c、d四点中v正与v逆均相等
D. 25 min时,导致平衡移动的原因是升温
查看习题详情和答案>>
已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )

A. 反应进行到10 min时,体系吸收的热量为9.68 kJ
B. 前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
查看习题详情和答案>>
