题目内容
已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )

A. 反应进行到10 min时,体系吸收的热量为9.68 kJ
B. 前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
【答案】
A
【解析】略

练习册系列答案
相关题目
 已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.4kJ/mol
已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图.下列推理分析合理的是( )
| A、前10min内,用v(NO2)表示的该反应速率为0.02mol/L?min | B、反应进行到10min时,体系吸收的热量为9.76kJ | C、a,b,c,d四点中c正与v逆均相等 | D、25min时,导致平衡移动的原因是升温 |
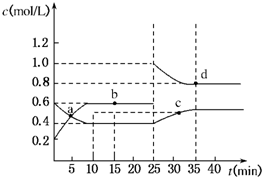 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )| A、反应进行到10 min时,体系吸收的热量为9.68 kJ | B、前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L?min) | C、a、b、c、d四点中v正与v逆均相等 | D、25 min时,导致平衡移动的原因是升温 |
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。
下列推理分析合理的是
| A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min) |
| B.反应进行到10 min时,体系吸收的热量为9.68 kJ |
| C.a、b、c、d四点中v正与v逆均相等 |
| D.25 min时,导致平衡移动的原因是升温 |
