网址:http://m.1010jiajiao.com/timu3_id_85238[举报]
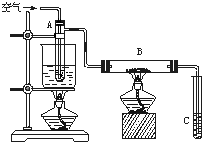 某课外活动小组用如图所示进行乙醇的催化氧化实验探究,试管A中盛有无水乙醇,B中装有CuO(用石棉绒作载体),试管C中放的是蒸馏水.请回答下列问题:
某课外活动小组用如图所示进行乙醇的催化氧化实验探究,试管A中盛有无水乙醇,B中装有CuO(用石棉绒作载体),试管C中放的是蒸馏水.请回答下列问题:(1)向试管A中鼓入空气的目的是
(2)玻璃管B中可观察到的现象是
相关化学方程式是
(3)在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是
(4)烧杯中水的作用是

请回答下列问题:
(1)装置F中发生反应的离子方程式是
| ||
| ||
(2)装置A中的烧瓶内固体可选用
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.B
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:
(5)若从装置C和G处逸出的尾气中含有N2和少量Cl2,应如何处理?
某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸。
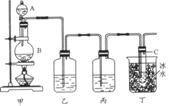
完成下列问题:
(1)烧瓶B中盛____________,大试管C中盛____________。
(2)C中发生反应的化学方程式________________________________________________ 。
(3)有同学认为可以省去某些装置,你认为怎样?
①能否省去乙装置_________(答“能”或“不能”),理由是_____________________________。
查看习题详情和答案>>某课外活动小组用如图所示的实验装置探究氯气与氨气之问的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
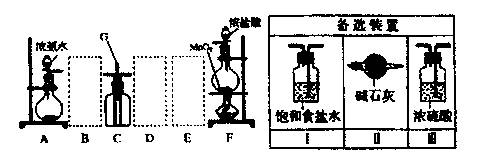
请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石'灰 B.浓硫酸
C.生石灰 D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的各选装置中选择,并将编号填入下列空格。
B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为 ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C的G处逸出的尾气中含有N2和少量Cl2,应如何处理?
查看习题详情和答案>> 某课外活动小组用如图所示装置进行实验(电解液足量).下列说法正确的是( )
某课外活动小组用如图所示装置进行实验(电解液足量).下列说法正确的是( )