摘要:17.按要求回答下列问题: (1)0.01 mol/L的硫酸氢钠溶液.在其中滴入等体积的pH=12的Ba(OH)2溶液后.所发生反应的离子方程式为 . (2)配平 Cr2O+ I-+ H+―→ Cr3++ I2+ H2O (3)已知1 g乙醇完全燃烧生成液态水放出29.72 kJ的热量.写出该反应的热化学方程式 . 解析:2溶液.c[Ba(OH)2]=0.005 mol/L.因此等体积的二者反应时.NaHSO4和Ba(OH)2的物质的量之比为2?1.发生反应的离子方程式:2H++SO+Ba2++2OH-===BaSO4↓+2H2O.(2)根据得失电子守恒配平该离子方程式.(3)1 mol乙醇燃烧时放出的热量为29.72 kJ×46=1367.12 kJ.因此乙醇燃烧的热化学方程式为:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l),ΔH=-1367.12 kJ/mol. 答案:(1)2H++SO+Ba2++2OH-===BaSO4↓+2H2O (2)1 6 14 2 3 7 (3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l),ΔH=-1367.12 kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_85197[举报]
电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
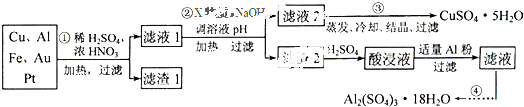
按要求回答下列问题:
(1)滤渣1中存在的金属有 .
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是 (填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是 .
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是 .
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应: .
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在 (填仪器名称)中加热脱水.
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是 (填序号)
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
>
D.
<
.
查看习题详情和答案>>

按要求回答下列问题:
(1)滤渣1中存在的金属有
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应:
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
请按要求回答下列问题:
(1)将100mL0.3mol?L-1的NaHSO4(设该条件下NaHSO4完全电离)溶液和100mL0.2mol?L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程:
(2)某温度时,水的离子积常数KW═10-13,将此温度下pH═11的Ba(OH)2溶液aL与pH═1的H2SO4溶液bL混合.设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b═
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)═1.8×10-10,Ksp(AgY)═1.0×10-12,Ksp(AgZ)═8.7×10-17.则AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
查看习题详情和答案>>
(1)将100mL0.3mol?L-1的NaHSO4(设该条件下NaHSO4完全电离)溶液和100mL0.2mol?L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程:
3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O
3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O
;若向反应后的溶液中滴加2~3滴酚酞试液,则溶液的颜色变为红色
红色
.(2)某温度时,水的离子积常数KW═10-13,将此温度下pH═11的Ba(OH)2溶液aL与pH═1的H2SO4溶液bL混合.设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b═
10:1
10:1
.(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)═1.8×10-10,Ksp(AgY)═1.0×10-12,Ksp(AgZ)═8.7×10-17.则AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
S(AgX)>S(AgY)>S(AgZ)
S(AgX)>S(AgY)>S(AgZ)
;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减小
减小
(填“增大”、“减小”或“不变”).按要求回答下列问题
(1)用离子方程式解释纯碱溶液去除油污的原因:
(2)写出泡沫灭火器中反应的离子方程式[内液:Al2(SO4)3,外液:NaHCO3]:
(3)SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾生成,并有无色有刺激性气味气体逸出,该气体中含有使品红溶液褪色的SO2,根据实验现象,写出SOCl2与水反应的化学方程式:
蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H20混合并加热,可得到无水AlCl3,解释原因:
(4)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为
②铅蓄电池在充电时阳极反应为
③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
(5)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)=
查看习题详情和答案>>
(1)用离子方程式解释纯碱溶液去除油污的原因:
CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-
(2)写出泡沫灭火器中反应的离子方程式[内液:Al2(SO4)3,外液:NaHCO3]:
3HCO3-+Al3+=Al(OH)3↓+3CO2↑
3HCO3-+Al3+=Al(OH)3↓+3CO2↑
(3)SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾生成,并有无色有刺激性气味气体逸出,该气体中含有使品红溶液褪色的SO2,根据实验现象,写出SOCl2与水反应的化学方程式:
SOCl2+H2O=2HCl↑+SO2↑
SOCl2+H2O=2HCl↑+SO2↑
删去此空
删去此空
蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H20混合并加热,可得到无水AlCl3,解释原因:
反应产生的氯化氢气体会抑制铝离子的水解
反应产生的氯化氢气体会抑制铝离子的水解
(4)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
| 放电 | 充电 |
①铅蓄电池在放电时负极反应为
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,②铅蓄电池在充电时阳极反应为
PbSO4+2H2O-2e-=4H++SO42-+PbO2
PbSO4+2H2O-2e-=4H++SO42-+PbO2
;③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4
2
2
mol.(5)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)=
10-8
10-8
mol/L. (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:


(2)实验室用两种固体制取NH3的反应化学方程式为
2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑
| ||
2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑
.
| ||
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
2NH3+NaClO=N2H4+NaCl+H2O
2NH3+NaClO=N2H4+NaCl+H2O
.(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
<
<
0(填“>”、“<”或“=”).②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
| n(NH3) |
| n(CO2) |
c(NH3)增大,平衡正向移动
c(NH3)增大,平衡正向移动
.图中A点处,NH3的平衡转化率为42%
42%
.(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
逆向
逆向
(填“正向或“逆向”)移动.②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为
甲=乙=丙
甲=乙=丙
. 乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.
乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.试根据上述信息,回答下列问题.
(1)(MY)x- 的结构简式如图,该离子中与金属离子相连接的有6个共价键,则该离子结构中共含有
5
5
个五元环.(2)现称取某铝盐试样0.2500g,将其溶于水后加入0.05000mol?L-1 EDTA溶液25.00mL,在适当条件下充分反应后,调节溶液的pH为5~6,加入指示剂二甲酚橙,再用0.02000mol?L-1的Zn(CH3COO)2溶液25.00mL 滴定至红色[Zn2+遇二甲酚橙所显色,且Zn(CH3COO)2易电离],求该试样中铝元素的质量分数.
(3)按要求回答下列问题:①有一起始含0.01mol?L-1的M2+、0.5mol?L-1 EDTA(Y4-)和0.001mol?L-1的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀.
| M2+ | K[(MY)2-] | Ksp(MS) | 填“是”或“否” |
| Pb2+ | 2×1018 | 4×10-26 | |
| Cd2+ | 2.6×1016 | 1×10-20 |
因为EDTA过量许多,若Cd2+充分反应生成(MCd)2-应为0.01mol?L-1;假设(CdY)2-的离解量为x,所以c[(CdY)2-]=(0.01-x)mol?L-1,c(Cd2+)=xmol?L-1,c(Y4-)=(0.49+x)mol?L-1;
因x<<0.01,所以K((CdY)2-)=
=
≈
=2.6×1016,
解得:x≈7.8×10-18;
c(Cd2+)?c(S2-)=x?c(S2-)=7.8×10-18×0.001=7.8×10-22<Ksp(CdS),所以不生成沉淀.
因x<<0.01,所以K((CdY)2-)=
| C((CdY) 2-) |
| c(Cd2+)×c(Y4-) |
| 0.01-x |
| x×(0.49+x) |
| 0.01 |
| 0.49x |
解得:x≈7.8×10-18;
c(Cd2+)?c(S2-)=x?c(S2-)=7.8×10-18×0.001=7.8×10-22<Ksp(CdS),所以不生成沉淀.
因为EDTA过量许多,若Cd2+充分反应生成(MCd)2-应为0.01mol?L-1;假设(CdY)2-的离解量为x,所以c[(CdY)2-]=(0.01-x)mol?L-1,c(Cd2+)=xmol?L-1,c(Y4-)=(0.49+x)mol?L-1;
因x<<0.01,所以K((CdY)2-)=
=
≈
=2.6×1016,
解得:x≈7.8×10-18;
c(Cd2+)?c(S2-)=x?c(S2-)=7.8×10-18×0.001=7.8×10-22<Ksp(CdS),所以不生成沉淀.
.因x<<0.01,所以K((CdY)2-)=
| C((CdY) 2-) |
| c(Cd2+)×c(Y4-) |
| 0.01-x |
| x×(0.49+x) |
| 0.01 |
| 0.49x |
解得:x≈7.8×10-18;
c(Cd2+)?c(S2-)=x?c(S2-)=7.8×10-18×0.001=7.8×10-22<Ksp(CdS),所以不生成沉淀.