网址:http://m.1010jiajiao.com/timu3_id_84956[举报]
钛(Ti)被称为“生物金属”,由TiOΡ制取Ti的主要反应:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TICl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
下列说法不正确的是
- A.反应①②都是氧化还原反应
- B.反应②是置换反应
- C.反应①中TiO2:是氧化剂
- D.反应②中每生成1mol Ti转移4 mol电子
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
a.左型酒石酸盐晶体和右型酒石酸盐晶体的关系是________.
b.下列化合物中具有与左,右型酒石酸盐的关系相同的是________.
(用序号表示)
①丙烯酸甲酯
②葡萄糖
③CHClBrCH2F2
④甘油
⑤2-氨基丙酸
⑥乳酸
(2)化学是一个美丽的学科,她向我们展示了微观世界中分子原子的规律.根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是________和________,________和________.(用序号表示)
①H3PO4
②HClO
③H3BO3
④HNO2
(3)过渡元素可谓是藏龙卧虎,那里有熔点最高的钨,有贵重金属金,某元素的基态原子的正三价离子的3d能级为半充满状态.检验该离子常用试剂是________,反应的离子方程式为________,正三价离子外围电子排布图是________.钛被称为未来金属,钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式应表示为________.
(4)甲烷晶体晶胞结构如图,与一个甲烷分子紧密相邻的甲烷分子有________个.

(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤Ⅱ发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O
①步骤Ⅰ中发生反应的化学方程式:
②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为
③在步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)
| 高温 |
②TiCl4+2Mg
| 高温 |
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是:
(3)若已知:C(s)+O2(g)=CO2(g)△H=-394kJ/mol,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为

(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是___________________________;
步骤②冷却的目的是______________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是__________;考虑成本和废物综合利用因素,废液中应加入__________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为
TiO2→TiCl4![]() Ti
Ti
已知:①C(s)+O2(g)![]() CO2(g);ΔH=-393.5 KJ·mol-1
CO2(g);ΔH=-393.5 KJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g);ΔH=-566 KJ·mol-1
2CO2(g);ΔH=-566 KJ·mol-1
③TiO2(s)+2Cl2(g)![]() TiCl4(s)+O2(g);ΔH=+141 KJ·mol-1
TiCl4(s)+O2(g);ΔH=+141 KJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)![]() TiCl4(s)+2CO(g)的ΔH=________________。
TiCl4(s)+2CO(g)的ΔH=________________。
反应TiCl4+2Mg![]() 2MgCl2+Ti在Ar气氛中进行的理由是________________。
2MgCl2+Ti在Ar气氛中进行的理由是________________。

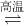 TiCl4(g)+O2(g);△H=+151kJ/mol
TiCl4(g)+O2(g);△H=+151kJ/mol