题目内容
金属钛被称为“21世纪金属”.
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤Ⅱ发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O
①步骤Ⅰ中发生反应的化学方程式:______、______.
②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为______.
③在步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在______范围.
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:______.
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)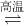 TiCl4(g)+O2(g);△H=+151kJ/mol
TiCl4(g)+O2(g);△H=+151kJ/mol
②TiCl4+2Mg 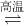 2MgCl2+Ti
2MgCl2+Ti
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是:______.
(3)若已知:C(s)+O2(g)=CO2(g)△H=-394kJ/mol,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为______.
解:(1)①氧化铝是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水:Al2O3+2NaOH=2NaAlO2+H2O,二氧化硅是酸性氧化物,能和强碱反应生成硅酸钠和水:SiO2+2NaOH=Na2SiO3+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
②Fe2+在酸性条件下能被H2O2氧化成Fe3+,H2O2被还原成水:2Fe2++H2O2+2H+=2Fe3++2H2O;故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③胶体的粒子直径大小为:1~100nm,所以步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在1~100nm,故答案为:1~100nm;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-,故答案为:TiO2+4e-=Ti+2O2-;
TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4,
故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4;
(3)将方程式TiO2(s)+2Cl2(g)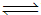 TiCl4(l)+O2(g)△H=+151kJ?mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ?mol-1相加,得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ?mol-1-394kJ?mol-1=-243KJ?mol-1,
TiCl4(l)+O2(g)△H=+151kJ?mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ?mol-1相加,得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ?mol-1-394kJ?mol-1=-243KJ?mol-1,
故答案为:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=-243KJ?mol-1.
分析:(1)①根据二氧化硅、氧化铝和氢氧化钠的性质分析;
②Fe2+在酸性条件下能被H2O2氧化成Fe3+,H2O2被还原成水;
③根据胶体的粒子直径大小为:1~100nm;
(2)阴极上得电子反应还原反应生成金属钛;根据外界条件对化学平衡的影响分析;
(3)利用盖斯定律来解答.
点评:本题考查了热化学反应方程式、电极反应式的书写等知识点,难度不大,注意热化学反应方程式相加减时,反应热应相应的加减.
②Fe2+在酸性条件下能被H2O2氧化成Fe3+,H2O2被还原成水:2Fe2++H2O2+2H+=2Fe3++2H2O;故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③胶体的粒子直径大小为:1~100nm,所以步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在1~100nm,故答案为:1~100nm;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-,故答案为:TiO2+4e-=Ti+2O2-;
TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4,
故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4;
(3)将方程式TiO2(s)+2Cl2(g)
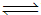 TiCl4(l)+O2(g)△H=+151kJ?mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ?mol-1相加,得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ?mol-1-394kJ?mol-1=-243KJ?mol-1,
TiCl4(l)+O2(g)△H=+151kJ?mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ?mol-1相加,得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ?mol-1-394kJ?mol-1=-243KJ?mol-1,故答案为:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=-243KJ?mol-1.
分析:(1)①根据二氧化硅、氧化铝和氢氧化钠的性质分析;
②Fe2+在酸性条件下能被H2O2氧化成Fe3+,H2O2被还原成水;
③根据胶体的粒子直径大小为:1~100nm;
(2)阴极上得电子反应还原反应生成金属钛;根据外界条件对化学平衡的影响分析;
(3)利用盖斯定律来解答.
点评:本题考查了热化学反应方程式、电极反应式的书写等知识点,难度不大,注意热化学反应方程式相加减时,反应热应相应的加减.

练习册系列答案
相关题目
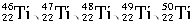 ,则下列说法正确的是 ()。
,则下列说法正确的是 ()。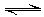 TiO2?H2O+H2SO4,正反应为吸热反应。
TiO2?H2O+H2SO4,正反应为吸热反应。