摘要:12.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究其反应原理.现进行如下实验.在体积为2 L的密闭容器中.充入2 mol CO2和6 mol H2.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),ΔH=-49.0 kJ·mol-1.测得CO2和CH3OH(g)的浓度随时间变化如图所示. (1)从反应开始到平衡.CO2的平均反应速率v(CO2)= mol/. (2)下列措施中能使CO2的转化率增大的是 . A.加入催化剂 B.升高温度 C.恒容充入He(g).使体系压强增大 D.再充入1 mol CO2和3 mol H2 (3)下列说法正确的是 . A.反应进行到3 s时达到平衡 B.只有平衡时有v(CO2)/v(H2)=1∶3 C.反应进行到3 s时浓度关系为c(CH3OH)=c(CO2) D.2 mol CO2和6 mol H2反应达到平衡时放热73.5 kJ 解析:(1)10 s时.反应达到平衡.CO2的浓度变化为:1.00 mol/L-0.25 mol/L=0.75 mol/L.故二氧化碳的反应速率v(CO2)=0.75 mol/L÷10 s=0.075 mol/. (2)加入催化剂不能使平衡发生移动.二氧化碳的转化率不变,已知正反应为放热反应.升高温度.二氧化碳的转化率降低,恒容条件下充入稀有气体导致的压强增大不能改变反应物及生成物的浓度.所以不能改变转化率,再充入相同比例的反应物时.反应体系的压强增大.平衡向正反应方向移动.二氧化碳的转化率增大. (3)反应进行到3 s时.二氧化碳和甲醇的浓度相同.但反应没有达到平衡,反应过程中.用不同物质表示的反应速率的大小与化学方程式中的化学计量数成正比.即反应过程中v(CO2)∶v(H2)=1∶3,达到平衡时.二氧化碳的转化率为75%.故放出的热量为2 mol×75%×49.0 kJ/mol=73.5 kJ. 答案:CD
网址:http://m.1010jiajiao.com/timu3_id_84831[举报]
Ⅰ以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工业.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g) CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,
该反应在常温下
(2)目前工业上有一种方法是用CO与H2反应来生产甲醇.
已知生成气态甲醇,CO里面含C≡O.请写出该反应的热化学方程式为
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol
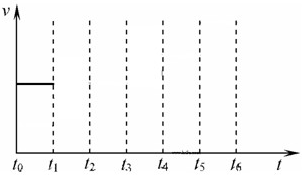 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.则通丙烷的电极发生的电极反应为
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-=[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是: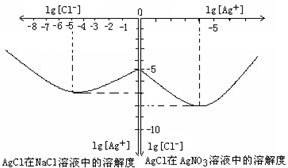
查看习题详情和答案>>
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)
 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,该反应在常温下
不能
不能
自发进行(填“能”与“不能”);在一体积为2L的密闭容器中,加入1molC和2mol H2O(g),达平衡时H2O的转化率为20%,请计算此时的平衡常数0.05
0.05
(2)目前工业上有一种方法是用CO与H2反应来生产甲醇.
| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)
 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.则通丙烷的电极发生的电极反应为
C3H8+10O2--20e-=3CO2+4H2O
C3H8+10O2--20e-=3CO2+4H2O
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-=[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
10-12
10-12
.(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了.
开始Cl-抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl-浓度增大使AgCl形成[AgCl2]-络合物:AgCl+Cl-=[AgCl2]-,所以Ag+浓度又变大了.
.
 目前工业上有一种方法是用CO2来生产燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,为探究反应原理,现进行如下实验:
目前工业上有一种方法是用CO2来生产燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和4mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).(2)该反应的平衡常数表达式为
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和4mol H2
(4)如果在相同的容器中事先充入1mol CH3OH和1mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为
1mol
1mol
.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量的变化.
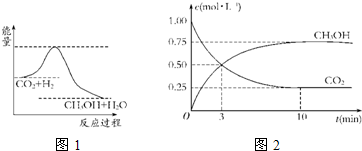
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该图中能量的最高点和最低点之间的差值代表
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2
和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H2)
(4)肼(N2H4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该图中能量的最高点和最低点之间的差值代表
逆反应的活化能
逆反应的活化能
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2
和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H2)
0.225
0.225
mol?L-1?min-1.(4)肼(N2H4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.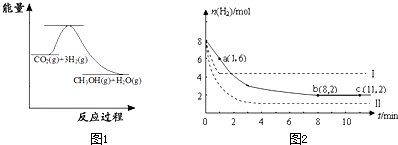
(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.该反应是
(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H2)=
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH.
查看习题详情和答案>>

(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.该反应是
放热
放热
(填“吸热”或“放热”)反应.(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H2)=
1mol/(L?min)
1mol/(L?min)
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
升高温度
升高温度
,曲线Ⅱ改变的实验条件是增大压强
增大压强
.(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
D
D
(填选项).A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
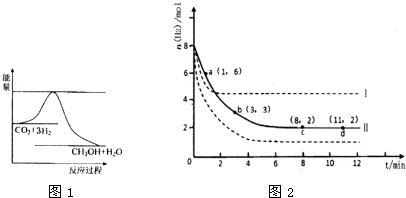
(1)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
①该反应是
②反应体系中加入催化剂对反应热是否有影响?
(2)若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①该条件下反应的平衡常数K=
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图2中虚线所示,曲线I对应的实验条件改变是
③下列措施中能使H2转化率增大的是
A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离出来 D.再充入3mol CO2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ?mol-1
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
查看习题详情和答案>>

(1)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
①该反应是
放热
放热
(填“吸热”或“放热”)反应.②反应体系中加入催化剂对反应热是否有影响?
否
否
(填“是”或“否”).(2)若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①该条件下反应的平衡常数K=
0.5
0.5
.②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图2中虚线所示,曲线I对应的实验条件改变是
升高温度
升高温度
,曲线Ⅱ对应的实验条件改变是增大压强
增大压强
.③下列措施中能使H2转化率增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离出来 D.再充入3mol CO2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ?mol-1
H2(g)+
| 1 | 2 |
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ?mol-1
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ?mol-1
.