摘要:4.已知A.B.C.D.E是短周期中原子序数依次增大的5种主族元素.其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍.元素C在同周期的主族元素中原子半径最大.元素D的合金是日常生活中常用的金属材料.下列说法不正确的是( ) A.元素A.B组成的化合物常温下一定呈气态 B.一定条件下.元素C.D的最高价氧化物对应的水化物之间能发生反应 C.工业上常用电解法制备元素C.D.E的单质 D.化合物AE与CE含有相同类型的化学键 解析:B元素原子的最外层电子数是其电子层数的2倍.则B为碳元素,C元素的原子序数大于6.且在同周期主族元素中原子半径最大.故C为钠元素,D元素的合金是日常生活中的常用金属材料.则D为铝元素.第三周期元素E的单质常温下呈气态为Cl2.所以E为氯元素.原子序数小于6的A元素能形成气态单质.则A为氢元素.化合物HCl和NaCl中含有的化学键类型不同. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84743[举报]
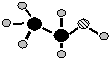 已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是
氯
氯
(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
;(2)由A、B、C三种元素组成的化合物的球棍结构如图所示,试写出利用植物秸秆生产这种物质的化学方程式
(C6H10O5)n+nH2O
nC6H12O6
| 催化剂 |
| △ |
(C6H10O5)n+nH2O
nC6H12O6
、| 催化剂 |
| △ |
C6H12O6
2CH3CH2OH+2CO2↑
| 一定条件 |
C6H12O6
2CH3CH2OH+2CO2↑
.| 一定条件 |
(2011?烟台模拟)已知A、B、C、D、E是短周期中的5种元素,它们的原子序数依次增大.A在周期表中原子半径最小,B原子的最外层电子数是内层电子数的2倍,D元素与A元素同主族.E元素与C元素同主族;E的单质为黄色晶体,易溶于二硫化碳.
①画出A的阴离子的结构示意图
 .
.
②C的单质和D的单质在点燃条件下反应生成化合物X,该反应的化学方程式为
③将9gB单质在足量的C单质中燃烧,所得气体通入1L1.0mol?L-1NaOH溶液中,完全吸收后,溶液中存在的离子按浓度由大到小的排列顺序是
④将E的单质在足量的C的单质中燃烧,所得主要气体为Y.将Y通入X中,X与Y可能发生的反应的化学方程式有
查看习题详情和答案>>
①画出A的阴离子的结构示意图


②C的单质和D的单质在点燃条件下反应生成化合物X,该反应的化学方程式为
2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.将产物加入滴有酚酞的水中,观察到的现象为
| ||
有无色气体放出,溶液先变红,后褪色
有无色气体放出,溶液先变红,后褪色
.③将9gB单质在足量的C单质中燃烧,所得气体通入1L1.0mol?L-1NaOH溶液中,完全吸收后,溶液中存在的离子按浓度由大到小的排列顺序是
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.④将E的单质在足量的C的单质中燃烧,所得主要气体为Y.将Y通入X中,X与Y可能发生的反应的化学方程式有
2Na2O2+2SO2═2Na2SO3+O2↑、Na2O2+SO2═Na2SO4
2Na2O2+2SO2═2Na2SO3+O2↑、Na2O2+SO2═Na2SO4
.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A的原子半径是元素周期表中所有元素原子中最小的,B原子的最外层电子数是内层电子数的2倍.C、D在元素周期表中处于相邻的位置,E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳.
(1)请写出元素符号:A
(2)画出E的阴离子的结构示意图:
 .
.
(3)将12gB单质在足量的D单质中燃烧,所得气体通入1L1mol?L-1的NaOH溶液中,完全吸收后,溶液中大量存在的阴离子是
查看习题详情和答案>>
(1)请写出元素符号:A
H
H
,BC
C
,CN
N
,DO
O
,ES
S
.(2)画出E的阴离子的结构示意图:


(3)将12gB单质在足量的D单质中燃烧,所得气体通入1L1mol?L-1的NaOH溶液中,完全吸收后,溶液中大量存在的阴离子是
HCO3-
HCO3-
.已知A、B、C、D、E是短周期元素,它们的原子序数逐渐增大.A元素原子形成的离子没有电子;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳.
(1)A的离子符号是
(2)C、D的最高价氧化物的水化物相互反应的离子方程式是
(3)A、B、C三种元素形成的化合物所含的化学键类型是
(4)B、C、D三种元素的离子半径由大到小的顺序是
查看习题详情和答案>>
(1)A的离子符号是
H+
H+
;(2)C、D的最高价氧化物的水化物相互反应的离子方程式是
Al(OH)3+OH-=[Al(OH)4]-
Al(OH)3+OH-=[Al(OH)4]-
;(3)A、B、C三种元素形成的化合物所含的化学键类型是
离子键、共价键
离子键、共价键
;(4)B、C、D三种元素的离子半径由大到小的顺序是
O2->Na+>Al3+
O2->Na+>Al3+
.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:C>D>A>B | B、C和E的单质可通过电解饱和的CE水溶液获得 | C、C与B形成的两种化合物中化学键类型完全相同 | D、A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |