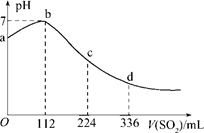
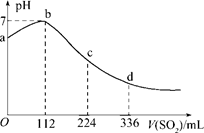
摘要:4.标准状况下.某同学向100 mLH2S饱和溶液中通入SO2.所得溶液pH变化如图所示.下列分析中.正确的是 ( ) A.ab段反应是:SO2+2H2S===3S↓+2H2O B.亚硫酸是比氢硫酸更弱的酸 C.原H2S溶液的物质的量浓度为0.05 mol/L D.b点对应的溶液导电性最强 解析:H2SH++HS-.溶液显酸性.当通入SO2时.SO2+2H2S===3S↓+2H2O.即ab段发生的反应.A项正确.溶液酸性减弱.导电性减弱.D项错误.当通入112 mL SO2时恰好反应完全.所以c(H2S)===0.1 mol/L.C项错误.继续通入SO2.SO2+H2O===H2SO3.H2SO3H++HSO.由图象知.d点比a点pH小.即等物质的量浓度的H2SO3比H2S的电离程度大.H2SO3比H2S酸性强.B项错误. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_84622[举报]
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )。

A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看习题详情和答案>>
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是
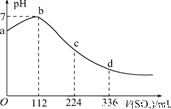
A.亚硫酸是比氢硫酸更弱的酸
B.ab段反应是:SO2+2H2S===3S↓+2H2O
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看习题详情和答案>>
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是
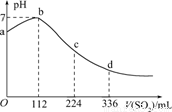
A.亚硫酸是比氢硫酸更弱的酸
B.ab段反应是:SO2+2H2S===3S↓+2H2O
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看习题详情和答案>>