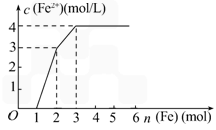
摘要:4.某稀溶液中含有Fe(NO3)2.Cu(NO3)2.HNO3.若向其中逐渐加入铁粉.溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示.则稀溶液中Fe(NO3)2.Cu(NO3)2.HNO3物质的量浓度之比为 ( ) A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4 解析:加入Fe粉的过程中发生的反应依次为: Fe+4HNO3===Fe(NO3)3+NO↑+2H2O ① Fe+2Fe3+===3Fe2+ ② Fe+Cu2+===Fe2++Cu ③ 铁粉加至1 mol前是与HNO3反应.由反应①知原溶液中HNO3为4 mol(生成1 mol Fe3+).铁粉从1 mol到2 mol时是与Fe3+反应.消耗2 mol Fe3+.据反应②知原有的Fe(NO3)2为2 mol-1 mol.铁粉从2 mol到3 mol时.由反应③得其中1 mol Fe 消耗Cu2+ 1 mol.所以Fe(NO3)2.Cu(NO3)2.HNO3物质的量浓度之比为1∶1∶4. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84285[举报]
某稀溶液中含有Fe(NO3)2、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示,则稀溶液中Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为
[ ]
A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
查看习题详情和答案>>
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
|
某稀溶液中含有Fe(NO3)2、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)2、Cu(NO3)2、HNO3物质的量浓度之比为 | |
| [ ] | |
A. |
1∶1∶1 |
B. |
1∶3∶1 |
C. |
3∶3∶8 |
D. |
1∶1∶4 |
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 …( )
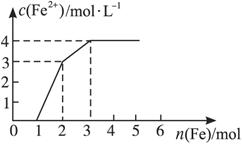
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
查看习题详情和答案>>