摘要:盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成.整个过程的热效应是相同的. 已知:①H2O(g) H2O(1),△H= - Q1kJ/mol, ②C2H5OH(g) C2H5OH(1),△H= - Q2kJ/mol, ③C2H5OH(g)+3O2(g) 2CO2(g)+3H2O(g),△H= - Q3kJ/mol, 下列判断正确的是( ) A.酒精的燃烧热为Q3kJ B.若使23g液体酒精完全燃烧.最后恢复到室温.释放出的热量为(1.5Q1-0.5Q2+0.5Q3)kJ C.H2O(g)→H2O(1)释放出了热量.所以该过程为化学变化 D.从反应③可知1molC2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
网址:http://m.1010jiajiao.com/timu3_id_84129[举报]
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
下列判断正确的是( )
已知:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
下列判断正确的是( )
查看习题详情和答案>>
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
| A.酒精的燃烧热为Q3 kJ |
| B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
A.酒精的燃烧热为Q3 kJ
B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量
查看习题详情和答案>>
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知: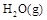


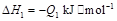
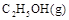


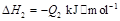
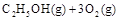

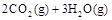
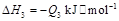
若使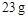 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(
)
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(
)
A. B.
B.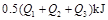
C.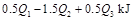 D.
D.
查看习题详情和答案>>
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
已知:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
下列判断正确的是( )
查看习题详情和答案>>
已知:①H2O(g)═H2O(l);△H=-Q1 kJ/mol;
②C2H5OH(g)═C2H5OH(l);△H=-Q2kJ/mol;
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.
下列判断正确的是( )
| A.酒精的燃烧热为Q3kJ |
| B.若使23 g液体酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量 |