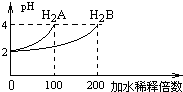
摘要:常温下.取pH=2的两种二元酸H2A与H2B各1ml.分别加水稀释.测得PH变化与加水稀释倍数有如图所示变化.则下列有关叙述正确的是( ) A.H2A的电离方程式为H2A H++HA-.HA- H++A2- B.PH=4的NaHA水溶液中离子浓度大小为 c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) C.含NaHA.NaHB的混合溶液中.离子浓度大小为 c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) D.Na2B的水溶液中.离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
网址:http://m.1010jiajiao.com/timu3_id_84127[举报]
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
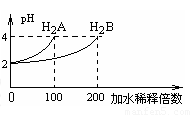
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L试卷
C.pH=3的NaHA水溶液中,离子浓度大小为试卷
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为试卷
c(Na+)>c(B2-)>c(OH-)>c(H+)
查看习题详情和答案>>
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
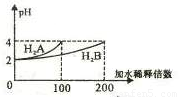
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
查看习题详情和答案>>
 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )