题目内容
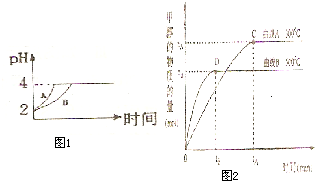
 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )分析:pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,由图可知,稀释100倍时H2A的pH变化大,且pH=4,所以H2A为强酸,H2B为弱酸,以此来解答.
解答:解:A.pH=2的二元酸H2A加水稀释,由图可知,稀释100倍时H2A的pH=4,所以H2A为强酸,故A错误;
B.由图可知,稀释100倍时H2A的pH变化大,且pH=4,所以H2A为强酸,H2B为弱酸,所以c(H2B)>c(H2A)=0.005mol/L,故B错误;
C.pH=3的NaHA水溶液中,NaHA═Na++H++A2-,H2O?H++OH-,所以c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故C错误;
D.H2B为弱酸,Na2B的水溶液中,Na2B═2Na++B2-,B2-+H2O?HB-+OH-,所以离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+),故D正确;
故选D.
B.由图可知,稀释100倍时H2A的pH变化大,且pH=4,所以H2A为强酸,H2B为弱酸,所以c(H2B)>c(H2A)=0.005mol/L,故B错误;
C.pH=3的NaHA水溶液中,NaHA═Na++H++A2-,H2O?H++OH-,所以c(H+)>c(Na+)=c(A2-)>c(OH-)>c(H2A),故C错误;
D.H2B为弱酸,Na2B的水溶液中,Na2B═2Na++B2-,B2-+H2O?HB-+OH-,所以离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+),故D正确;
故选D.
点评:本题考查弱电解质的电离及离子浓度大小的比较,明确稀释及图象的分析是解答本题的关键,并注意电离与水解相结合来解答,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用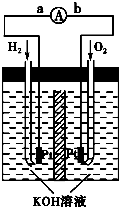 方向为
方向为 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: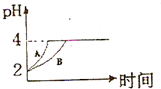 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是