摘要:(二)﹑后期 选择题专题集中复习.分两个阶段进行: 第一阶段:重点练习和讲解以下高考热点题:1.饱和溶液.溶解度.溶液浓度的计算.2.化学反应速率和化学平衡的有关计算.3.阿佛加德罗常数的有关计算.4.气体的有关计算等. 第二阶段:对计算型选择题速解训练. 在练习讲评中.向学生介绍几种速解方法: 等效变换.妙用守恒.极端假设.拆分合并.巧用差量.分析比较.逆向思维.中间平均等.每种方法配一道题讲评.提高学生的解题能力和解题速度.
网址:http://m.1010jiajiao.com/timu3_id_84107[举报]
下列关于胶体的叙述中, 不正确的是
[ ]
A.利用某些复分解反应或盐类的水解反应, 可以制备胶体溶液.
B.在氢氧化铁胶体溶液中通直流电时, 阴极附近颜色加深, 这是因为Fe3+ 向阴极集中,OH-向阳极集中.
C.胶体区别于其他分散系的本质特征是胶体中分散质微粒直径在1nm~100nm 之间.
D.一般条件下, 胶体溶液比较稳定, 主要原因是胶体有丁达尔现象.
查看习题详情和答案>>2012诺贝尔化学奖于10月10日揭晓,颁发给了生物化学领域的两位科学家:美国医学家罗伯特?J?尼科威和美国生物学家布莱恩?克比尔卡.对于两位科学家所做的研究,美国化学会主席巴萨姆?萨卡什里说:“这是向人类智慧的一次伟大致敬,它帮助我们了解在人类的身体中到底发生了什么复杂的过程.”下列选项属于2012诺贝尔化学奖获奖原因的是( )
| A、准晶体的发现 | B、G蛋白偶联受体研究 | C、对有机合成中钯催化偶联反应的研究 | D、发展了有机合成中的复分解法 |
(I)多项选择题
下列有关化工生产的说法中不正确的是
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:
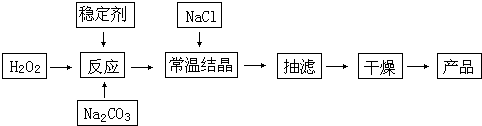
试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
查看习题详情和答案>>
下列有关化工生产的说法中不正确的是
ADE
ADE
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:

试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
强氧化性
强氧化性
,下列四种物质可使过碳酸钠较快失效的是ABC
ABC
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
降低2Na2CO3?3H2O2溶解度,析出更多晶体
降低2Na2CO3?3H2O2溶解度,析出更多晶体
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
催化双氧水的分解
催化双氧水的分解
,反应方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
温度高时双氧水易分解
温度高时双氧水易分解
,温度偏低时造成产率偏低的可能原因是温度低时反应慢
温度低时反应慢
,而该流程中还是遗漏了一步操作,造成产品产率偏低,这步操作名称是洗涤
洗涤
.(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
1
1
mol/L.(已知:H2O2+2HBr=Br2+2H2O)