摘要:(二) 归纳总结.对比分析.掌握常见仪器装置的用途与用法 根据实验目的.考虑实验原理.合理选择实验用品是进行化学实验的前提.要正确选择实验用品.首先必须明确实验仪器的用途与用法.不少实验都会用到同一种仪器. 例如:测定硝酸钾在水中的溶解度实验.制取乙烯的实验.制取硝基苯的实验.石油分馏实验等都要用到温度计.由于要测定温度的物质或环境不同.因此温度计水银球的位置也不同.
网址:http://m.1010jiajiao.com/timu3_id_84096[举报]
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是( )
| A、pH=1和pH=2的盐酸,c(H+)之比为1:2 | B、物质A三态间的转化如下:A(g)→A(l)→A(s),则该转化过程中△S<0 | C、pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 | D、pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,两溶液中水的电离程度相同 |
某同学用如图一所示装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象.
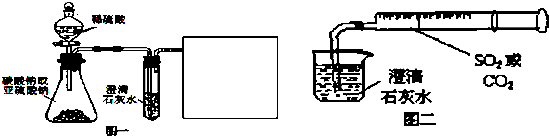
(1)SO2是空气污染物之一,它的危害是
(2)图一中生成CO2反应的离子方程式为
(3)如何鉴别CO2和SO2(只需要写出一种方法,应写出操作方法、现象和结论)?
(4)用图一进行SO2与石灰水反应的实验时,从环保角度考虑,还需要增加什么装置,在方框中画出
 .
.
(5)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是
查看习题详情和答案>>

(1)SO2是空气污染物之一,它的危害是
会形成酸雨
会形成酸雨
.(2)图一中生成CO2反应的离子方程式为
CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
;(3)如何鉴别CO2和SO2(只需要写出一种方法,应写出操作方法、现象和结论)?
将两种气体分别通入品红溶液,褪色的是SO2,不褪色的是CO2
将两种气体分别通入品红溶液,褪色的是SO2,不褪色的是CO2
.(4)用图一进行SO2与石灰水反应的实验时,从环保角度考虑,还需要增加什么装置,在方框中画出


(5)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是
SO2溶解度大,图一中SO2与石灰水反应时SO2过量直接生成酸式盐,因而看不到沉淀
SO2溶解度大,图一中SO2与石灰水反应时SO2过量直接生成酸式盐,因而看不到沉淀
.(2012?武汉模拟)某同学欲探究Na2S2O3的有关化学性质,设计如下实验流程图.
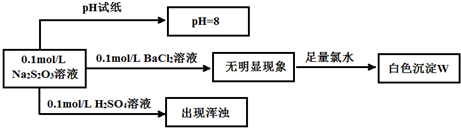
请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
(2)写出生成白色沉淀W所涉及的离子方程式:
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
①V=
②探究浓度对化学反应速率的影响,应选择
③为了准确控制反应的温度,应采用的加热方式为
查看习题详情和答案>>

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
(2)写出生成白色沉淀W所涉及的离子方程式:
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
否
否
(填“能”、“否”);(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
2
2
;②探究浓度对化学反应速率的影响,应选择
甲、乙
甲、乙
(填实验编号)组实验进行对比分析;③为了准确控制反应的温度,应采用的加热方式为
水浴加热
水浴加热
.某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa c.NaHCO3 d.NaOH,其溶质物质的量浓度由小到大顺序为:d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka?Kh=Kw
⑥甲、乙两溶液都是强电解质已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
查看习题详情和答案>>
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa c.NaHCO3 d.NaOH,其溶质物质的量浓度由小到大顺序为:d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka?Kh=Kw
⑥甲、乙两溶液都是强电解质已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka?Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka?Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
| A、①④ | B、①②④ | C、①②④⑤ | D、①②③④ |