摘要:25molH2在一定条件下发生反应.测得CO2. CH3OH(g)和H2O随时间变 化如右图所示: ①从反应开始到平衡.氢气的平均反应速率v(H2) = . ②下列措施中一定不能使CO2的转化率增大的是 . A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2 C.在原容器中充入1mol氦气 D.使用更有效的催化剂 E.缩小容器的容积 F.将水蒸气从体系中分离 (2)常温常压下.饱和CO2水溶液的pH=5.6.c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离.则H2CO3+H+的电离平衡常数K= .(已知:10-5.6=2.5×10-6). (3)标准状况下,将4.48LCO2通入200mL1.5mol/L 的NaOH溶液.所得溶液中离子浓度由大到小的顺序为 . (4)如图是甲醇燃料电池的 结构示意图.则a处通入的是 (填“甲醇 或 “氧气 ).其电极上发生的电极反应式为 . (5)已知.常温下Ksp=2.0×10-10.Ksp =5.4×10-13. 向BaCl2溶液中加入AgNO3和KCl.当两种沉淀共存时.溶液中c(Br-) 和c(Cl-)的比值为 .
网址:http://m.1010jiajiao.com/timu3_id_83963[举报]
如何降低大气中CO2含量及有效地开发利用CO2是当前科学家研究的重要课题。
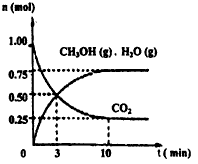
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如图所示:
①从反应开始到3min,氢气的平均反应速率v(H2)=__________;
②下列措施中一定能使CO2的转化率增大的是_________。
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2 C.在原容器中充入1mol氦气
D.使用更有效的催化剂 E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3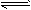
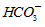 +H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6)
+H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6)
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析
CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析
①从反应开始到3min,氢气的平均反应速率v(H2)=__________;
②下列措施中一定能使CO2的转化率增大的是_________。
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2 C.在原容器中充入1mol氦气
D.使用更有效的催化剂 E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
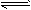
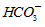 +H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6)
+H+的电离平衡常数 K=__________ 。(已知:10-5.6=2.5×10-6)(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析
CH3CH2OH(g)+3H2O(g) ΔH=a kJ/mol,在一定压强下,测得该反应的实验数据如下表。请根据表中数据分析
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变)。
③增大的值,则生成乙醇的物质的量____(填“增大”、“减小”、“不变”或“不能确定”)。
查看习题详情和答案>>
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变)。
③增大的值,则生成乙醇的物质的量____(填“增大”、“减小”、“不变”或“不能确定”)。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.
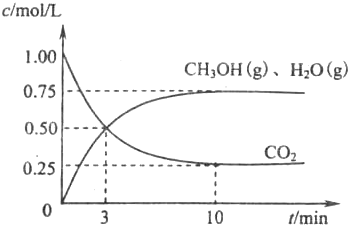
①写出该工业方法制取甲醇的化学方程式:______.
②从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min).平衡时CO2的转化事为______.
③该条件下反应的平衡常数K的值为______.当温度降低时K值变大,剐该反应的△H______0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:______.
查看习题详情和答案>>
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.

①写出该工业方法制取甲醇的化学方程式:______.
②从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min).平衡时CO2的转化事为______.
③该条件下反应的平衡常数K的值为______.当温度降低时K值变大,剐该反应的△H______0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:______.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.
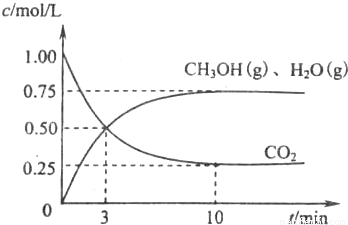
①写出该工业方法制取甲醇的化学方程式: .
②从反应开始到平衡,氢气的平均反应速率v(H2)= mol/.平衡时CO2的转化事为 .
③该条件下反应的平衡常数K的值为 .当温度降低时K值变大,剐该反应的△H 0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为: . 查看习题详情和答案>>
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.

①写出该工业方法制取甲醇的化学方程式: .
②从反应开始到平衡,氢气的平均反应速率v(H2)= mol/.平衡时CO2的转化事为 .
③该条件下反应的平衡常数K的值为 .当温度降低时K值变大,剐该反应的△H 0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为: . 查看习题详情和答案>>
(2011?河西区一模)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.

①写出该工业方法制取甲醇的化学方程式:
②从反应开始到平衡,氢气的平均反应速率v(H2)=
③该条件下反应的平衡常数K的值为
④下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:
查看习题详情和答案>>
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.

①写出该工业方法制取甲醇的化学方程式:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
. CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)②从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).平衡时CO2的转化事为75%
75%
.③该条件下反应的平衡常数K的值为
2.25
2.25
.当温度降低时K值变大,剐该反应的△H<
<
0(填“<”、“>”或“=”)④下列措施中能使n(CH3OH)/n(CO2)增大的是
C
C
.A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2?某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:
2CO2+4e-+2H2O=2CO+4OH-
2CO2+4e-+2H2O=2CO+4OH-
.
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=______.
②下列措施中一定不能使CO2的转化率增大的是______.
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为______.
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是______(填“甲醇”或
“氧气”),其电极上发生的电极反应式为______.
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向AgNO3溶液中加入KBr和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为______.

 查看习题详情和答案>>
查看习题详情和答案>>
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=______.
②下列措施中一定不能使CO2的转化率增大的是______.
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为______.
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是______(填“甲醇”或
“氧气”),其电极上发生的电极反应式为______.
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向AgNO3溶液中加入KBr和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为______.

 查看习题详情和答案>>
查看习题详情和答案>>