题目内容
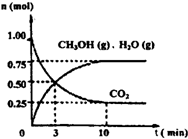
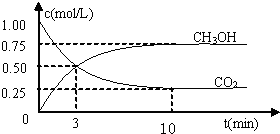
如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=______.
②下列措施中一定不能使CO2的转化率增大的是______.
A.在原容器中再充入1molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气 D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).
HCO3-+H+的电离平衡常数K=______.(已知:10-5.6=2.5×10-6).(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为______.
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是______(填“甲醇”或
“氧气”),其电极上发生的电极反应式为______.
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13.向AgNO3溶液中加入KBr和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为______.


【答案】分析:(1)①反应的方程式为CO2+3H2═CH3OH+H2O,根据反应速率之比等于化学计量数之比计算氢气的反应速率;
②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施;
(2)根据平衡常数K=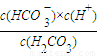 计算;
计算;
(3)4.48LCO2通入200mL1.5mol/L的NaOH溶液反应后生成0.01molNa2CO3和0.01molNaHCO3,CO32-水解大于HCO3-离子的水解,溶液呈碱性,以此判断离子浓度大小;
(4)在碱性电解质溶液中通入甲醇,甲醇被氧化为CO32-离子,甲醇应为原电池的负极,发生氧化反应,电极反应式为CH3OH+8OH--6e-═CO32-+6H2O;
(5)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算两种离子的浓度比值.
解答:解:(1)①反应的方程式为CO2+3H2═CH3OH+H2O,反应中v(H2)=3v(CO2)= =0.1125mol/(L?min),故答案为:0.1125mol/(L?min);
=0.1125mol/(L?min),故答案为:0.1125mol/(L?min);
②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施,在原容器中再充入1molCO2,虽然平衡向正反应移动,
但转化的量比较少,反而导致CO2的转化率降低,在原容器中充入1mol氦气和使用催化剂,平衡不移动,故答案为:ACD;
(2)K=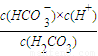 =
=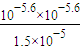 =4.2×10-7,故答案为:4.2×10-7;
=4.2×10-7,故答案为:4.2×10-7;
(3)4.48LCO2通入200mL1.5mol/L的NaOH溶液反应后生成0.01molNa2CO3和0.01molNaHCO3,CO32-水解大于HCO3-离子的水解,则c(HCO3-)>c(CO32-),溶液呈碱性,则
c(OH-)>c(H+),两种盐水解程度较小,则c(CO32-)>c(OH-),故为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)在碱性电解质溶液中通入甲醇,甲醇应为原电池的负极,发生氧化反应,甲醇被氧化为CO32-离子,负极反应为CH3OH+8OH--6e-═CO32-+6H2O,
故答案为:甲醇;CH3OH+8OH--6e-═CO32-+6H2O;
(5)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=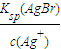 ,c(Cl-)=
,c(Cl-)=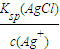 ,则
,则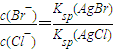 =
=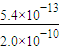 =2.7×10-3.
=2.7×10-3.
故答案为:2.7×10-3.
点评:本题考查较为综合,涉及反应速率、化学平衡、盐类的水解、原电池以及难溶电解质的溶解平衡的等知识,题目难度较大,本题易错点为平衡移动和离子浓度大小的比较两个问题,做题时注意把握做题的方法.
②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施;
(2)根据平衡常数K=
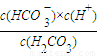 计算;
计算;(3)4.48LCO2通入200mL1.5mol/L的NaOH溶液反应后生成0.01molNa2CO3和0.01molNaHCO3,CO32-水解大于HCO3-离子的水解,溶液呈碱性,以此判断离子浓度大小;
(4)在碱性电解质溶液中通入甲醇,甲醇被氧化为CO32-离子,甲醇应为原电池的负极,发生氧化反应,电极反应式为CH3OH+8OH--6e-═CO32-+6H2O;
(5)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算两种离子的浓度比值.
解答:解:(1)①反应的方程式为CO2+3H2═CH3OH+H2O,反应中v(H2)=3v(CO2)=
 =0.1125mol/(L?min),故答案为:0.1125mol/(L?min);
=0.1125mol/(L?min),故答案为:0.1125mol/(L?min);②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施,在原容器中再充入1molCO2,虽然平衡向正反应移动,
但转化的量比较少,反而导致CO2的转化率降低,在原容器中充入1mol氦气和使用催化剂,平衡不移动,故答案为:ACD;
(2)K=
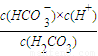 =
=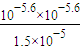 =4.2×10-7,故答案为:4.2×10-7;
=4.2×10-7,故答案为:4.2×10-7;(3)4.48LCO2通入200mL1.5mol/L的NaOH溶液反应后生成0.01molNa2CO3和0.01molNaHCO3,CO32-水解大于HCO3-离子的水解,则c(HCO3-)>c(CO32-),溶液呈碱性,则
c(OH-)>c(H+),两种盐水解程度较小,则c(CO32-)>c(OH-),故为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)在碱性电解质溶液中通入甲醇,甲醇应为原电池的负极,发生氧化反应,甲醇被氧化为CO32-离子,负极反应为CH3OH+8OH--6e-═CO32-+6H2O,
故答案为:甲醇;CH3OH+8OH--6e-═CO32-+6H2O;
(5)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
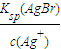 ,c(Cl-)=
,c(Cl-)=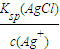 ,则
,则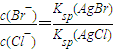 =
=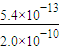 =2.7×10-3.
=2.7×10-3.故答案为:2.7×10-3.
点评:本题考查较为综合,涉及反应速率、化学平衡、盐类的水解、原电池以及难溶电解质的溶解平衡的等知识,题目难度较大,本题易错点为平衡移动和离子浓度大小的比较两个问题,做题时注意把握做题的方法.

练习册系列答案
相关题目
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.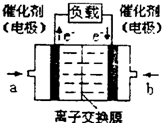
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注 (2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视. (2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视. HCO3-+OH-
HCO3-+OH-