摘要:答案:实验I:3mol/LH2SO4.氯化钠固体(或6mol/LHCl.硫酸钠固体) 实验II:大于2Al+Fe2O32Fe + Al2O3, , .2Al+2OH-+2H2O=2AlO2-+3H2↑,, [解析]实验I:(1)两实验现象的差异原因应从反应物组成的不同点去寻找.此题中其他条件均相同.不同的是盐酸中含有Cl-而硫酸中含有SO42-.所以从这个方面思考即可得答案, (2)根据控制变量法和对比实验法.在控制其他条件相同时.只让两实验中有一个变量不同.如:都用稀硫酸.但其中一份加入Cl-而另一份不加Cl-.即可得出结论. 实验II:由化学方程式可知.等物质的量的HCl与NaOH相比.NaOH消耗的铝更多.所以留下的铝就少.故“前者大于后者 , (1)根据信息和有关物质的性质.可以看出黑色固体可能是铝.铁.硅三种单质中的一种或几种.从而提出猜想.猜想1中铁的生成是由于电解法时生成的铝能与氧化铁发生铝热反应.由此可写出相应的化学反应方程式,猜想2的化学反应方程式根据题意就可直接写出, (2)①在盐酸中固体完全溶解.证明一定不含硅.所以猜想2一定不正确, ②在氢氧化钠溶液中固体完全溶解.证明一定不含铁.所以猜想1一定不正确, 中相应的结论.可知此固体只含有铝.故猜想3正确.猜想4不正确.固体是铝.铝与氢氧化钠溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
网址:http://m.1010jiajiao.com/timu3_id_83958[举报]
 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.实验过程中,对量气管的操作是
调整量气管,使其左右管中水面始终持平
调整量气管,使其左右管中水面始终持平
.③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
.A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
. (2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:
(2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:

猜想I:甲酸具有酸性;
实验I:在甲酸溶液中滴加紫色石蕊试液;
猜想II:甲酸能发生银镜反应;
实验II:操作过程如右图所示;
回答下列问题:
(1)请你再设计出至少2个实验方案来验证甲酸的酸性:
测定pH或滴加Na2CO3溶液
测定pH或滴加Na2CO3溶液
、或将甲酸滴加到滴有酚酞的NaOH溶液中
或将甲酸滴加到滴有酚酞的NaOH溶液中
;(2)请你进一步设计实验方案证明甲酸是弱酸
测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等
测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等
;(3)依右上图所示的实验,加热20分钟后并没有出现预期的实验现象.该小组同学预期的实验现象是
出现银镜
出现银镜
,请你从理论上简单解释实验中没有出现该现象的原因由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质;羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型;或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质;羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型;或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性
;(4)在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
①你提出的猜想是
甲酸在浓硫酸的作用下脱水生成CO和H2O
甲酸在浓硫酸的作用下脱水生成CO和H2O
;②你设计的实验方案是:


实验方案请参考如下形式:

实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理
Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-.取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中肯定含有的离子是①
Ⅱ、兴趣小组通过实验探究溶解铜的方法和本质.
(1)在热水浴中进行3个实验,部分实验报告如下表所示.
①实验I、II的目的是
②实验III中反应的本质是(用离子方程式表示)
查看习题详情和答案>>
Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-.取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中肯定含有的离子是①
H+、NH4+、Ba2+、I-
H+、NH4+、Ba2+、I-
;肯定不存在的离子是②Mg2+、Fe3+、SO32-、CO32-
Mg2+、Fe3+、SO32-、CO32-
;还不能确定是否存在的离子是③K+、Na+、Cl-
K+、Na+、Cl-
.Ⅱ、兴趣小组通过实验探究溶解铜的方法和本质.
(1)在热水浴中进行3个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 | I | 稀硫酸中加入铜片 | 无明显变化 | II | 硝酸钠溶液中加入铜片 | 无明显变化 | III | 稀硫酸中加入硝酸钠溶液 | 无明显变化 | 再加入铜片 | 有无色气泡;溶液变蓝 |
证明Cu不与H+、NO3-单独反应
证明Cu不与H+、NO3-单独反应
.②实验III中反应的本质是(用离子方程式表示)
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式: .
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为 .
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.
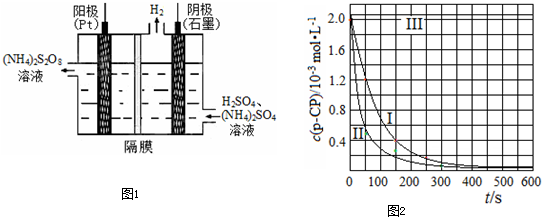
①电解时,阳极的电极方程式 ;
②写出生成H2O2的反应的化学方程式: .
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
①请根据实验I的曲线,计算降解反应
在50~150s内的反应速率ν(p-CP)= mol?L-1?s-1.
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因: .
③实验Ⅲ得出的结论是:pH=10时, .
查看习题详情和答案>>
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ?mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2O(l)=H2O(g)△H=44kJ?mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l) 的热化学方程式:
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含 H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如图1所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式
②写出生成H2O2的反应的化学方程式:
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如图2所示.
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
在50~150s内的反应速率ν(p-CP)=
②实验Ⅰ、Ⅱ表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:
③实验Ⅲ得出的结论是:pH=10时,