摘要:答案: (1) CaCO3+2H+=Ca2++CO2↑+H2O,吸收从B装置中的试管内逸出的氨气.减少对环境的污染 (2)温度越低.碳酸氢钠的溶解度越小.便于析出 (3)A与B, 饱和NaHCO3溶液,除去CO2中混合的HCl气体 (4)60%
网址:http://m.1010jiajiao.com/timu3_id_83956[举报]
已知某些化合物的溶度积常数见下表:
现有某种KNO3溶液,欲除去其中混有的少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3.若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3ˉ和少量H+、OHˉ,则加入试剂顺序正确的是(过滤步骤除外)( )
查看习题详情和答案>>
| 化学式 | Ksp | 化学式 | Ksp |
| AgBr | 5.0×10-13 | Ag2CO3 | 8.1×10-12 |
| Ag3PO4 | 1.4×10-16 | CaCO3 | 2.8×10-9 |
| AgOH | 2.0×10-8 | Ca3(PO4)2 | 2.0×10-29 |
 (2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:
①Na2CO3溶液
②HCl(盐酸)
③Ba(OH)2溶液,这三种试剂的添加顺序是
③①②
③①②
(填序号).(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
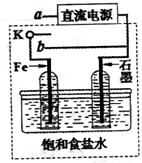
.(3)某同学设计了如图装置进行以下电化学实验.
①当开关K与a连接时,两极均有气泡产生,则阴极为
Fe(或铁)
Fe(或铁)
极.②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为
原电池
原电池
.请写出此时Fe电极上的电极反应式Fe-2e-+2OH-=Fe(OH)2↓
Fe-2e-+2OH-=Fe(OH)2↓
.(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好.再通入CO2,则逐渐产生大量(NH4)2SO4.请分析其原因[已知常温下:Ksp(CaSO4)=3.2×10-5,Ksp(CaCO3)=2.8×10-9].
松花蛋于明朝初年问世.其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl).将一定比例的配料用水和粘土调 制成糊状,敷于蛋上,密封保存,数日后即可食用.
(1)腌制皮蛋的配料用水调制时,主要反应的化学方程式为(不考虑粘土中物质可能参与的反应)
(2)松花蛋外的糊状物经水溶解、过滤,滤液中肯定大量含有的溶质为
(3)某同学设计如下表所示的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案.
问题讨论:在什么情况下不必做实验②就可以得出滤液中有无Na2CO3的结论?
查看习题详情和答案>>
(1)腌制皮蛋的配料用水调制时,主要反应的化学方程式为(不考虑粘土中物质可能参与的反应)
CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2 NaOH
CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2 NaOH
.(2)松花蛋外的糊状物经水溶解、过滤,滤液中肯定大量含有的溶质为
NaCl
NaCl
和NaOH
NaOH
,可能含有的物质为Ca(OH)2或Na2CO3.(3)某同学设计如下表所示的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案.
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取少量滤液,滴加适量K2CO3溶液 | 出现白色沉淀 出现白色沉淀 |
滤液中含 Ca(OH)2 Ca(OH)2 |
不出现白色沉淀 不出现白色沉淀 |
滤液中无 Ca(OH)2 Ca(OH)2 | |
| ②另取少量滤液,滴加 适量盐酸 适量盐酸 |
产生气泡 产生气泡 |
滤液中含 Na2CO3 Na2CO3 |
不产生气泡 不产生气泡 |
滤液中无 Na2CO3 Na2CO3 |
若实验①检验出有Ca(OH)2,则肯定没有Na2CO3的存在
若实验①检验出有Ca(OH)2,则肯定没有Na2CO3的存在
.