摘要:6.2 mol NH3发生反应:2NH3N2+3H2.达到平衡时.测得混合 气体的物质的量为3.6 mol.反应吸收的热量为73.6 kJ.下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是 ( ) A.3H2(g)+N2(g)2NH3(g) ΔH=-92 kJ/mol B.3H2(g)+N2(g)2NH3(g) ΔH=-368 kJ/mol C.3H2(g)+N2(g)2NH3(g) ΔH=-73.6 kJ/mol D.3H2(g)+N2(g)2NH3(g) ΔH=+73.6 kJ/mol 解析:根据计算.达到平衡时NH3只有0.4 mol.即氨气分解了1.6 mol.当氨气分解了1.6 mol时.吸收73.6 kJ的热量.如果氨气分解了2 mol.则吸收92 kJ的热量.由此可以写出氢气与氮气反应生成氨气的热化学反应方程式. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_83899[举报]
2 mol NH3发生反应:2NH3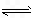 N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6 mol,反应吸收的热量为73.6 kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是
N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6 mol,反应吸收的热量为73.6 kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是
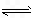 N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6 mol,反应吸收的热量为73.6 kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是
N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6 mol,反应吸收的热量为73.6 kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是 [ ]
A.3H2(g)+N2(g)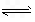 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
B.3H2(g)+N2(g) 2NH3(g) ΔH=-368 kJ/mol
2NH3(g) ΔH=-368 kJ/mol
C.3H2(g)+N2(g)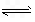 2NH3(g) ΔH=-73.6 kJ/mol
2NH3(g) ΔH=-73.6 kJ/mol
D.3H2(g)+N2(g)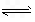 2NH3(g) ΔH=+73.6 kJ/mol
2NH3(g) ΔH=+73.6 kJ/mol
查看习题详情和答案>>
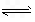 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol B.3H2(g)+N2(g)
 2NH3(g) ΔH=-368 kJ/mol
2NH3(g) ΔH=-368 kJ/mol C.3H2(g)+N2(g)
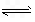 2NH3(g) ΔH=-73.6 kJ/mol
2NH3(g) ΔH=-73.6 kJ/molD.3H2(g)+N2(g)
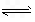 2NH3(g) ΔH=+73.6 kJ/mol
2NH3(g) ΔH=+73.6 kJ/mol (2013?日照一模)人工固氮是指将氮元素由游离态转化为化合态的过程.
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率.
总反应式为:N2(g)+3H2(g)
2NH3(g)
则在电解法合成氨的过程中,应将H2不断地通入
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)═4NH3(g)+3O2(g),△H=Q.
(1)上述反应的平衡常数表达式为
.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒玉密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数φ(N2)与反应温度T的关系曲线如图(1)所示,则上述反应的Q
(3)若上述反应在有人化剂的情况下发生,则如图(2)所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是
III.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1.
回答下列问题:
(1)结合II中的数据,则:2H2(g)+O2(g)=2H2O(g)的△H=

(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)
查看习题详情和答案>>
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率.
总反应式为:N2(g)+3H2(g)
| 通电 |
| 一定条件 |
则在电解法合成氨的过程中,应将H2不断地通入
阳
阳
极(填“阴”或“阳”);向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)═4NH3(g)+3O2(g),△H=Q.
(1)上述反应的平衡常数表达式为
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒玉密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数φ(N2)与反应温度T的关系曲线如图(1)所示,则上述反应的Q
>
>
0(填“>”、“<”或“=”).(3)若上述反应在有人化剂的情况下发生,则如图(2)所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是
d
d
(选填字母代号),图(2)中△H的绝对值为1530kJ?mol-1.III.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1.
回答下列问题:
(1)结合II中的数据,则:2H2(g)+O2(g)=2H2O(g)的△H=
-570kJ?mol-1
-570kJ?mol-1
.
(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=
60%
60%
.②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)
2
2
mol.