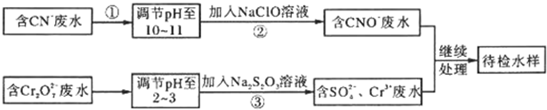
题目内容
(2013?日照一模)人工固氮是指将氮元素由游离态转化为化合态的过程.
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率.
总反应式为:N2(g)+3H2(g)
2NH3(g)
则在电解法合成氨的过程中,应将H2不断地通入
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)═4NH3(g)+3O2(g),△H=Q.
(1)上述反应的平衡常数表达式为
.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒玉密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数φ(N2)与反应温度T的关系曲线如图(1)所示,则上述反应的Q
(3)若上述反应在有人化剂的情况下发生,则如图(2)所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是
III.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1.
回答下列问题:
(1)结合II中的数据,则:2H2(g)+O2(g)=2H2O(g)的△H=

(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率.
总反应式为:N2(g)+3H2(g)
| 通电 |
| 一定条件 |
则在电解法合成氨的过程中,应将H2不断地通入
阳
阳
极(填“阴”或“阳”);向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g)═4NH3(g)+3O2(g),△H=Q.
(1)上述反应的平衡常数表达式为
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒玉密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数φ(N2)与反应温度T的关系曲线如图(1)所示,则上述反应的Q
>
>
0(填“>”、“<”或“=”).(3)若上述反应在有人化剂的情况下发生,则如图(2)所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是
d
d
(选填字母代号),图(2)中△H的绝对值为1530kJ?mol-1.III.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1.
回答下列问题:
(1)结合II中的数据,则:2H2(g)+O2(g)=2H2O(g)的△H=
-570kJ?mol-1
-570kJ?mol-1
.
(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=
60%
60%
.②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)
2
2
mol.分析:Ⅰ.在电解池中,阳极上发生失电子的氧化反应,阴极上发生得电子的还原反应,根据电解的总反应来书写电极反应;
Ⅱ.(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是吸热反应,即此反应的正反应为吸热反应;
(3)根据(2)的结论,反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能;
Ⅲ.(1)根据盖斯定律求出目标反应方程式,求出反应热;
(2)根据差量法求出参加反应的H2,然后求出转化率;
(3)根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol.
Ⅱ.(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是吸热反应,即此反应的正反应为吸热反应;
(3)根据(2)的结论,反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能;
Ⅲ.(1)根据盖斯定律求出目标反应方程式,求出反应热;
(2)根据差量法求出参加反应的H2,然后求出转化率;
(3)根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol.
解答:解:Ⅰ.跟据总反应式:N2+3H2
2NH3,氢气发生失电子的氧化反应,则在电解法合成氨的过程中,应将H2不断地通入阳极,在另一电极通入N2,发生得电子的还原反应,即N2+6H++6e-=2NH3;
故答案为:阳;N2+6H++6e-=2NH3;
Ⅱ.(1)上述反应的平衡常数表达式为:K=
,故答案为:
;
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是放热反应,即此反应的正反应为吸热反应,即△H>0,故答案为:>;
(3)根据(2)的结论,反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能,因此应该选d;
故答案为:d;
Ⅲ.(1)2N2(g)+6H2O(g)═4NH3(g)+3O2(g)△H=-1530kJ?mol-1 ①
N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1 ②
②×
-①×
,得:2H2(g)+O2(g)=2H2O(g)△H=2/3×(-93 kJ?mol-1)-1/3×(-1530 kJ?mol-1)=-570kJ?mol-1;
故答案为:-570kJ?mol-1;
(2)①N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1.8mol (4-2.8)mol
H2的转化率α1为转化率为
×100%=60%;
故答案为:60%;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol,所以起始时NH3的物质的量2mol,故答案为:2.
| 通电 |
| 一定条件 |
故答案为:阳;N2+6H++6e-=2NH3;
Ⅱ.(1)上述反应的平衡常数表达式为:K=
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
(2)曲线的变化先增大后变小.我们知道温度升高反应速率加快.在此题中,反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数随温度升高而变大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,则生成氨气的反应是放热反应,即此反应的正反应为吸热反应,即△H>0,故答案为:>;
(3)根据(2)的结论,反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能,因此应该选d;
故答案为:d;
Ⅲ.(1)2N2(g)+6H2O(g)═4NH3(g)+3O2(g)△H=-1530kJ?mol-1 ①
N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1 ②
②×
| 2 |
| 3 |
| 1 |
| 3 |
故答案为:-570kJ?mol-1;
(2)①N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1.8mol (4-2.8)mol
H2的转化率α1为转化率为
| 1.8mol |
| 3mol |
故答案为:60%;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol,所以起始时NH3的物质的量2mol,故答案为:2.
点评:本题以人工固氮为载体来考查化学反应原理中的电化学、化学反应的热效应、化学反应的限度(平衡态的建立、转化率、化学平衡与反应热),难度中等.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目