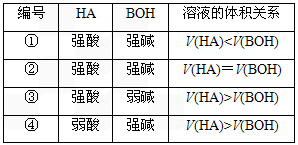
摘要:10.常温下.某酸HA溶液和某碱BOH溶液的物质的量浓度相同.两溶液混合后.溶液的pH=7.下列判断中合理的是 ( ) 编号 HA BOH 溶液的体积关系 ① 强酸 强碱 V(HA)<V(BOH) ② 强酸 强碱 V(HA)=V(BOH) ③ 强酸 弱碱 V(HA)>V(BOH) ④ 弱酸 强碱 V(HA)>V(BOH) A.①③ B.②③ C.②④ D.①④ 解析:强酸强碱混合呈中性.则体积相等.故① 错.②正确.若为③.当体积相等时生成强酸弱碱盐呈酸性.故V(HA)<V(BOH).错误,若为④.当体积相等时生成强碱弱酸盐呈碱性.故V(HA)>V(BOH).正确. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_83662[举报]
常温下,某酸HA溶液和某碱BOH溶液的浓度相同,两溶液混合后,溶液的pH=7,下列判断中合理的是
编号 | HA | BOH | 溶液的体积关系 |
① | 强酸 | 弱碱 | V(HA)<V(BOH) |
② | 强酸 | 弱碱 | V(HA)=V(BOH) |
③ | 强酸 | 弱碱 | V(HA)>V(BOH) |
④ | 弱酸 | 强碱 | V(HA)>V(BOH) |
A.①③ B.②③ C.②④ D.①④
查看习题详情和答案>>
常温下,某酸HA溶液和某碱BOH溶液的浓度相同,两溶液混合后,溶液的pH=7,下列判断中合理的是
编号 | HA | BOH | 溶液的体积关系 |
① | 强酸 | 弱碱 | V(HA)<V(BOH) |
② | 强酸 | 弱碱 | V(HA)=V(BOH) |
③ | 强酸 | 弱碱 | V(HA)>V(BOH) |
④ | 弱酸 | 强碱 | V(HA)>V(BOH) |
A.①③ B.②③ C.②④ D.①④
查看习题详情和答案>>在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.试分析其原因
查看习题详情和答案>>
(1)该温度下,水的离子积常数kw=
1×10-12
1×10-12
.(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
11
11
.(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
a+b=14(或pH1+pH2═14)
a+b=14(或pH1+pH2═14)
.(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.试分析其原因
HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液的pH=5
HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液的pH=5
.