网址:http://m.1010jiajiao.com/timu3_id_82966[举报]
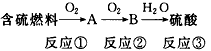
回答下列问题:
(1)A物质的化学式为_________,B物质的化学式为_________。
(2)3个反应中不属于氧化还原反应的是_________(填序号)。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的___ (填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)从环境保护的角度出发:雨水pH<5.6时,就判断为酸雨,已知pH= -lgc(H+),经测定某次雨水中只含硫酸,且浓度为5×l0-5mol/L,这次降雨 ___(填“是”或“不是”)酸雨。
(5)你认为减少酸雨产生的途径可采取的措施是___。
A.少用煤做燃料
B.把工厂的烟囱造高
C.燃料脱硫
D.把工厂迁移到农村
E.开发新能源
(11分)请仔细阅读下图和文字说明,回答后面提出的问题:
![]()

右图所示的区域包括三个市区,一个氯碱制造厂,一个废水处理厂和一个火力发电厂,两个厂都向河里排放污水。
![]() (1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
(1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
![]() (2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
(2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
![]() (3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(4)科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱制造厂进行横向联合。请你判断该方案是否可行? ;如果可行,请简述该方案的优点是 ,如果涉及到化学反应,其化学反应是 。
查看习题详情和答案>>形成酸雨的原理之一可简示如下;
含硫燃料 ![]() A→B→硫酸。
A→B→硫酸。
回答下列问题:
(1)A物质的化学式是________,B物质的化学式是________。
(2)三个反应中不属于氧化还原反应的是________。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”),除去SO2气体,达到减小污染的目的。
(4)从环境保护的角度,雨水的pH<5.6时就判断为酸雨。经测定某次雨水中只含硫酸,且浓度为1×10-5mo1·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明;高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,SO2地面浓度降低了30%之多。
Ⅰ.你认为减少酸雨产生的途径可采取的措施是________。
A. 少用煤作燃料 B. 把工厂烟囱造高 C. 燃料脱硫 D. 把工厂迁移到农村 E. 开发新能源
Ⅱ.请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取________,理由是_____________________________________________________。
查看习题详情和答案>>
含硫燃料 ![]() A→B→硫酸。
A→B→硫酸。
回答下列问题:
(1)A物质的化学式是________,B物质的化学式是________。
(2)三个反应中不属于氧化还原反应的是________。
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”),除去SO2气体,达到减小污染的目的。
(4)从环境保护的角度,雨水的pH<5.6时就判断为酸雨。经测定某次雨水中只含硫酸,且浓度为1×10-5mo1·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明;高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,SO2地面浓度降低了30%之多。
Ⅰ.你认为减少酸雨产生的途径可采取的措施是________。
A. 少用煤作燃料 B. 把工厂烟囱造高 C. 燃料脱硫 D. 把工厂迁移到农村 E. 开发新能源
Ⅱ.请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取________,理由是_____________________________________________________。
查看习题详情和答案>>