网址:http://m.1010jiajiao.com/timu3_id_82939[举报]
(Ⅰ)德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g) ![]() 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298 K下合成氨反应能自发进行(列出算式即可)___________________.其浓度熵(Qc) __________________化学平衡常数(Kc)(填“大于”“等于”或“小于”)时,反应向右进行.
(2)在实际工业合成氨生产中采取的措施是__________________ (填序号).
A.采用较低压强
B.采用800 K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
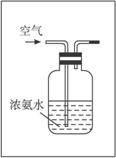
(3)如下图所示是实验室模拟工业法合成氨的简易装置,简述检验有氨气生成的方法
___________________________________________________________________________
___________________________________________________________________________.

(Ⅱ)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取.某校化学兴趣小组的同学设计了如下图所示装置利用中学实验室常见试剂制取NH3,并以空气,NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):

回答下列问题:
(1)实验时,A,C两装置均需加热,应先加热______________装置,原因是___________________;
(2)D装置中应填充的物质是______________,该物质的主要作用是______________;
(3)E装置的作用是______________,F,G装置中的物质分别是______________、______________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在如下图所示的方框中画出装置图并注明所用药品的名称).

回答下列问题:
(1)写出A中反应的化学方程式_________________,实验时,A、C两装置均需加热,应先加热_________________装置,原因是__________________________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是________________________。
(3)E装置的作用是_________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框中的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。

A.过滤 B.蒸发结晶 C.蒸馏 D.萃取 E.分液
(1)海水晒盐就是利用
(2)除去碳酸钙粉末中混有的碳酸钠,可先将混合物溶于水,再
(3)提取碘水中的碘单质,可先向碘水中加入四氯化碳进行
a→e→d→

Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验.请填写下表中的相应空格.
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜.该方案涉及的四种阳离子的氧化性由强到弱的顺序为:
(1)下列日常生活中的做法,符合“低碳生活”理念的是
A.节约使用纸张 B.分类回收处理垃圾
C.减少使用塑料袋 D.减少使用一次性纸杯、
(2)上海世博会使用的LED灯,为其提供电的装置接受阳光照射后,便可将
(3)为减少煤燃烧产生的二氧化硫对大气的污染,可向煤中加入适量的石灰石,发生的反应为:2CaCO3+O2+2SO2=2CaSO4+2CO2,该反应所涉及的物质中,属于氧化物的是
(3)目前使用的能源多为化石燃料,如天然气、石油和
A.取之不尽 B.清洁能源 C.不可再生能源 D.可转变成电能、热能.