摘要:12.利用右图所示装置可制备无水FeCl3.则下列说法正确的是 ( ) A.必须使用干燥的Cl2的原因是因为无水FeCl3会与水蒸气反应 B.有水存在时.得到的是FeCl2 C.若通入干燥的HCl气体则生成FeCl2 D.干燥管的作用是吸收多余的Cl2和防止空气中的水蒸气进入接受器 答案: 12.AD FeCl2可与水发生水解反应.用碱石灰的干燥管既可防止Cl2放人空气中.又可防止水蒸气进入接受器
网址:http://m.1010jiajiao.com/timu3_id_82900[举报]
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )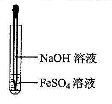
| A.氢氧化亚铁易被空气氧化 |
| B.氢氧化亚铁为灰绿色絮状沉淀 |
| C.可利用右图所示装置,制备氢氧化亚铁 |
| D.实验中所用氢氧化钠溶液应预先煮沸 |
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )

A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用右图所示装置,制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
查看习题详情和答案>>
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是

- A.氢氧化亚铁易被空气氧化
- B.氢氧化亚铁为灰绿色絮状沉淀
- C.可利用右图所示装置,制备氢氧化亚铁
- D.实验中所用氢氧化钠溶液应预先煮沸
某化学学习小组利用右图所示装置来探究相应物质的化学性质的顺序.选择适当试剂完成实验A、B、C,并得出相应的
实验结论.实验A、B、C所用试剂或所得结论列于下表中.
(1)乙装置的名称
(2)请填写①~⑤的试剂名称或实验结论:
①
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
查看习题详情和答案>>

实验结论.实验A、B、C所用试剂或所得结论列于下表中.
| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
锥形瓶
锥形瓶
. (2)请填写①~⑤的试剂名称或实验结论:
①
双氧水(过氧化氢溶液)
双氧水(过氧化氢溶液)
②氢硫酸溶液
氢硫酸溶液
③酸性:醋酸>碳酸>硅酸
酸性:醋酸>碳酸>硅酸
④浓氢氧化钠溶液(或饱和氢氧化钠溶液)
浓氢氧化钠溶液(或饱和氢氧化钠溶液)
⑤氯化铵固体(晶体)
氯化铵固体(晶体)
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
关闭分液漏斗的活塞,在丙中注一定量的水,将导管插入水中,微热锥形瓶,一段时间后在导管口看到有气泡产生,撤去酒精灯,在导管中产生一段水柱,说明装置的气密性良好
关闭分液漏斗的活塞,在丙中注一定量的水,将导管插入水中,微热锥形瓶,一段时间后在导管口看到有气泡产生,撤去酒精灯,在导管中产生一段水柱,说明装置的气密性良好
;②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
Cu+4HNO3=Cu(NO3)2+2NO2?+2H2O
Cu+4HNO3=Cu(NO3)2+2NO2?+2H2O
;③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
3NO2+H2O=2HNO3+NO,NO2和水反应生成的HNO3是一种强氧化性的酸,也可将Na2S氧化,也可使溶液变浑浊
3NO2+H2O=2HNO3+NO,NO2和水反应生成的HNO3是一种强氧化性的酸,也可将Na2S氧化,也可使溶液变浑浊
;(用化学反应方程式和简要文字回答)④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
2NO2+2OH-=NO3-+NO2-+H2O
2NO2+2OH-=NO3-+NO2-+H2O
. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |
请根据要求回答下列问题:
(1)若用右图所示装置来制备少量的乙酸乙酯,其中饱和碳酸钠溶液的作用是
吸收乙醇、中和乙酸及降低乙酸乙酯在水中的溶解度
吸收乙醇、中和乙酸及降低乙酸乙酯在水中的溶解度
.(2)此反应以浓硫酸为催化剂,可能会造成
产生大量的酸性废液
产生大量的酸性废液
、部分原料炭化
部分原料炭化
等问题.(3)在图所示的装置中进行50mL 0.50mol/L醋酸与50mL 0.55mol/L NaOH溶液的中和反应.通过测定反应过程中所放出的热量可计算反应热.回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
环形玻璃搅拌棒
环形玻璃搅拌棒
;②在题述反应条件下,测得反应前醋酸和NaOH溶液的温度均为25.43℃,反应后混合溶液的温度为28.73℃.已知反应前醋酸
和NaOH溶液的密度均为1.0g?cm-3,反应后混合溶液的比热容为c=4.18J/(g?℃).试写出中和反应的热化学方程式:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-55.18kJ?mol
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-55.18kJ?mol
.