摘要:3.重视课本知识.将元素及其化合物知识系统化.应用元素周期律来分析元素及其化合物的有关知识.掌握“位一构一性 之间关系.
网址:http://m.1010jiajiao.com/timu3_id_82452[举报]
元素及其化合物的知识是“化学1”的重点内容.下列叙述中不正确的是( )
| A、钠在空气中燃烧,生成淡黄色的过氧化钠粉末 | B、镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | C、在炼铁高炉中主要是CO将铁矿石还原为铁 | D、硅是应用广泛的半导体材料,常用于制作光导纤维 |
 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116KJ?mol-1
又知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则甲醇的燃烧热为
-739kJ?mol-1
-739kJ?mol-1
.(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为
0.4mol/(L?min)
0.4mol/(L?min)
;下列措施中有利于增大该反应的反应速率且提高转化率的是d
d
.a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
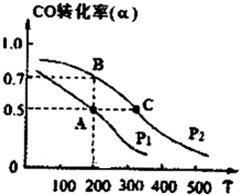
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA
大于
大于
tc(填“大于”、“小于’’或“等于“).②若A点时容器的体积为10L,该温度下B点的平衡常数K=
1
1
.(4)Na2SO3的水溶液呈
碱
碱
(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):SO32-+H2O?HSO3-+OH-
SO32-+H2O?HSO3-+OH-
;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
(已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9).