网址:http://m.1010jiajiao.com/timu3_id_82451[举报]
(1)某学生设计用如下实验方案用以检验淀粉水解的情况:

A.淀粉尚有部分未水解 B.淀粉已完全水解 C.淀粉没有水解
(2)取透明三角板、牙刷柄等废弃聚苯乙烯塑料制品碎片20~30 g,放入圆底烧瓶中,加入10 g碎玻璃渣和适量A12O3或无水A1C13并混合均匀。按下图安装好实验装置。B瓶收集液态产物,试管C中盛放稀的酸性高锰酸钾溶液或溴水。加热烧瓶,观察发生的现象。

①实验中加入A12O3或无水A1C13的作用是 ;
②B瓶收集液态产物是 ;
B.金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料。请回答下列问题:
(1)家庭中“钢精锅”是由铝合金做成的,它能否长期存放食盐水? 。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有 (填序号)。
①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
③在海轮的外壳上常焊有锌块,且定期更新
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
 ,俗名为水杨酸,在医学上具有 作用
,俗名为水杨酸,在医学上具有 作用 D.保持洁净安全的生存环境已成为全人类的共识。
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。
(2)人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是 技术。
已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
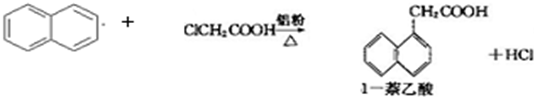
生产的主要流程为:
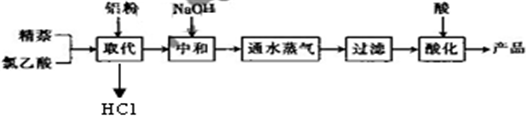
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有
(2)结合生产原理分析,生产中可循环利用的物质是
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | 溶解1-萘乙酸和氯乙酸、氯化铝等水溶性杂质 溶解1-萘乙酸和氯乙酸、氯化铝等水溶性杂质 |
| 2. 趁热过滤 趁热过滤 |
除去杂质萘; |
| 3. 取滤液 取滤液 ,再过滤,洗涤,干燥. |
得到提纯的产品1-萘乙酸. |
(共15分)I(8分) (1)(4分)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察 ,定性比较得出结
论。观察两同学的方案,你认为 (填“甲”或“乙”)更合理。 理由
是 。
 |
(2) (4分)丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
II(7分)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
查看习题详情和答案>>已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
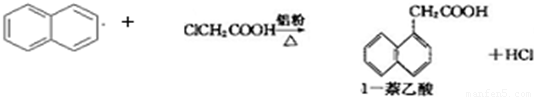
生产的主要流程为:
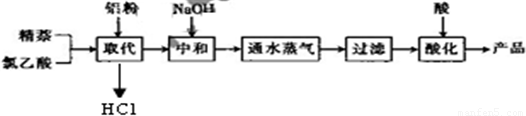
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |
查看习题详情和答案>>
已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
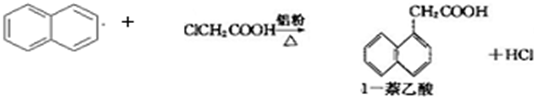
生产的主要流程为:
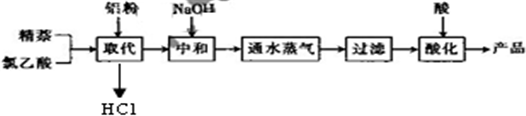
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |