网址:http://m.1010jiajiao.com/timu3_id_82429[举报]
(1)铝在元素周期表中的位置是
(2)已知电负性的数值表示原子对电子吸引能力的相对大小.以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | x | 1.8 |
②电负性的数值与元素金属性的关系是
③下列实验能比较镁和铝的金属性强弱的是
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1mol/LAlCl3和0.1mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一.
已知:4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3.液态铝在(填“阴”或“阳”)
铝及其化合物在生产生活中具有重要的作用.
(1)铝在元素周期表中的位置是______.
(2)已知电负性的数值表示原子对电子吸引能力的相对大小.以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | x | 1.8 |
②电负性的数值与元素金属性的关系是______.
③下列实验能比较镁和铝的金属性强弱的是______.
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1mol/LAlCl3和0.1mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一.
已知:4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是______.
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3.液态铝在(填“阴”或“阳”)______极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是______. 查看习题详情和答案>>

①该反应是氧化还原反应
②该反应一定是吸热反应
③Li2SiO3 和Li2FeSiO4属于硅酸盐
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是____________;实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的物质的量为________________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4
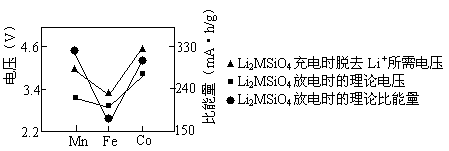
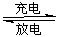 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。(4)三种Li2MSiO4的性能对比如下图所示。实际应用时,常用来源丰富的铁元素生产的
Li2FeSiO4作电极材料,使用该电极材料的另一个优点是___________________。

①该反应是氧化还原反应
②该反应一定是吸热反应
③Li2SiO3 和Li2FeSiO4属于硅酸盐
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是____________;实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的物质的量为________________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4
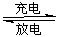 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。(4)三种Li2MSiO4的性能对比如下图所示。实际应用时,常用来源丰富的铁元素生产的
Li2FeSiO4作电极材料,使用该电极材料的另一个优点是___________________。

A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。
(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看习题详情和答案>>