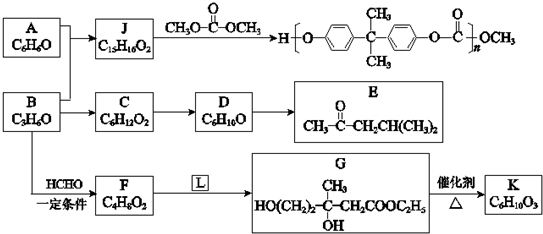
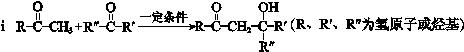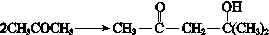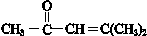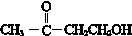题目内容
(2013?西城区二模)铝及其化合物在生产生活中具有重要的作用.
(1)铝在元素周期表中的位置是
(2)已知电负性的数值表示原子对电子吸引能力的相对大小.以下是几种原子的电负性数值:
①铝的电负性x的范围是
②电负性的数值与元素金属性的关系是
③下列实验能比较镁和铝的金属性强弱的是
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1mol/LAlCl3和0.1mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一.
已知:4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3.液态铝在(填“阴”或“阳”)
(1)铝在元素周期表中的位置是
第3周期第ⅢA族
第3周期第ⅢA族
.(2)已知电负性的数值表示原子对电子吸引能力的相对大小.以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | x | 1.8 |
1.2<χ<1.8
1.2<χ<1.8
.②电负性的数值与元素金属性的关系是
电负性数值越大,元素的金属性越弱
电负性数值越大,元素的金属性越弱
.③下列实验能比较镁和铝的金属性强弱的是
c
c
.a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1mol/LAlCl3和0.1mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一.
已知:4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是
4Al(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)△H=-1789kJ/mol
4Al(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)△H=-1789kJ/mol
.(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3.液态铝在(填“阴”或“阳”)
阴
阴
极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是在阳极发生反应2O2--4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
在阳极发生反应2O2--4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
.分析:(1)根据铝的电子层结构判断在周期表中的位置;
(2)①同一周期中,元素的电负性随着原子序数的增大而增大;
②金属性越强的元素其电负性越小;
③金属性强弱的判断方法有:置换氢气的难易程度、其最高价氧化物的水化物的碱性强弱、相同类型的盐的pH大小、
(3)根据盖斯定律进行解答;
(4)电解时阳离子在阴极得电子发生还原反应,阳极上氧离子得电子发生还原反应,碳和氧气反应.
(2)①同一周期中,元素的电负性随着原子序数的增大而增大;
②金属性越强的元素其电负性越小;
③金属性强弱的判断方法有:置换氢气的难易程度、其最高价氧化物的水化物的碱性强弱、相同类型的盐的pH大小、
(3)根据盖斯定律进行解答;
(4)电解时阳离子在阴极得电子发生还原反应,阳极上氧离子得电子发生还原反应,碳和氧气反应.
解答:解:(1)铝原子有3个电子层,最外层有3个电子,所以其在元素周期表中的位置是:第3周期第ⅢA族,故答案为:第3周期第ⅢA族;
(2)①同一周期中,元素的电负性随着原子序数的增大而增大,所以1.2<χ<1.8,故答案为:1.2<χ<1.8;
②根据金属的金属性和电负性知,电负性数值越大,元素的金属性越弱,故答案为:电负性数值越大,元素的金属性越弱;
③a.金属的导电性强弱不能证明金属的金属性强弱,故错误;
b.镁离子和铝离子的浓度不同,所以无法判断水解强弱,从而无法确定金属性强弱,故错误;
c.氢氧化镁不溶于氢氧化钠,而氢氧化铝能溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性强弱,故正确;
故选c;
(3)4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol①
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol②
将方程式①-②×3得4Al (s)+3MnO2 (s)=3Mn(s)+2Al2O3(s)△H=-3352kJ/mol-3(-521kJ/mol)=-1789 kJ/mol,
故答案为:4Al (s)+3MnO2 (s)=3Mn(s)+2Al2O3(s)△H=-1789 kJ/mol;
(4)电解熔融氧化铝时,阴极上铝离子得电子发生还原反应,阳极上氧离子失电子发生氧化反应生成氧气,氧气和碳反应生成二氧化碳,所以阳极质量逐渐减少,要不断补充,故答案为:阴;在阳极发生反应2O2--4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充.
(2)①同一周期中,元素的电负性随着原子序数的增大而增大,所以1.2<χ<1.8,故答案为:1.2<χ<1.8;
②根据金属的金属性和电负性知,电负性数值越大,元素的金属性越弱,故答案为:电负性数值越大,元素的金属性越弱;
③a.金属的导电性强弱不能证明金属的金属性强弱,故错误;
b.镁离子和铝离子的浓度不同,所以无法判断水解强弱,从而无法确定金属性强弱,故错误;
c.氢氧化镁不溶于氢氧化钠,而氢氧化铝能溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性强弱,故正确;
故选c;
(3)4Al (s)+3O2(g)=2Al2O3(s)△H1=-3352kJ/mol①
Mn(s)+O2(g)=MnO2 (s)△H2=-521kJ/mol②
将方程式①-②×3得4Al (s)+3MnO2 (s)=3Mn(s)+2Al2O3(s)△H=-3352kJ/mol-3(-521kJ/mol)=-1789 kJ/mol,
故答案为:4Al (s)+3MnO2 (s)=3Mn(s)+2Al2O3(s)△H=-1789 kJ/mol;
(4)电解熔融氧化铝时,阴极上铝离子得电子发生还原反应,阳极上氧离子失电子发生氧化反应生成氧气,氧气和碳反应生成二氧化碳,所以阳极质量逐渐减少,要不断补充,故答案为:阴;在阳极发生反应2O2--4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充.
点评:本题考查盖斯定律、电解原理、金属性强弱的判断方法等知识点,明确电解熔融氧化铝阳极石墨要不断不充的原因,为易错点.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
(2013?西城区二模)下列实验操作不能达到预期实验目的是( )
|