网址:http://m.1010jiajiao.com/timu3_id_82160[举报]
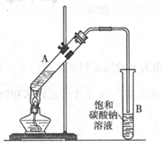
乙酸乙酯是重要的化工原料。实验室合成乙酸乙酯的装置如下图所示。

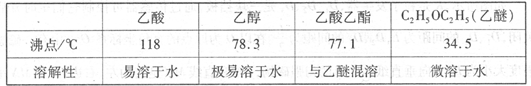
有关数据及副反应:

副反应:
C2H5OH+C2H5OH C2H5OC2H5+H2O
C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______ 、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________
查看习题详情和答案>>
乙酸乙酯是重要的化工原料。实验室合成乙酸乙酯的装置如下图所示。
有关数据及副反应:
副反应:
C2H5OH+C2H5OH C2H5OC2H5+H2O
C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______ 、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________
有关数据及副反应:
副反应:
C2H5OH+C2H5OH
 C2H5OC2H5+H2O
C2H5OC2H5+H2O请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______ 、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________

①当仪器的连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、_________。
②检查好装置的气密性后,加热B之前必须进行的操作是______________________。
(2)若平底烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化剂氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右的连接顺序为A→C→B→C,请写出B中氨的催化氧化反应方程式_________。
②装置B中可能观察到的现象是_______________________。
(3)若平底烧瓶中盛装MnO2分液漏斗中盛装浓盐酸,B中是纯铁粉,则可选用如图仪器装置制取纯净的FeCl3 (FeCl3遇水蒸气产生白雾)。
①根据气流方向,从图中选择适当的仪器进行实验,则装置的连接顺序为(填字母): A→( )→( )→( )→( )→( );实验过程中,A、B两处均需要加热但不能同时加热,应先加热_________(填“A”或“B”),理由是_________;B中的反应发生后就可以停止加热,这说明B中的反应是_________(填“吸”或“放”)热反应。
②设计一种方案,证实实验结束后,B中固体中仍存在一定量的铁单质________________。
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)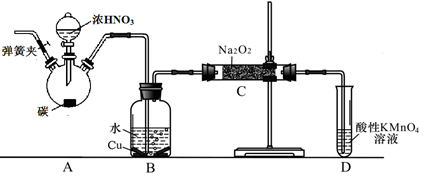
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
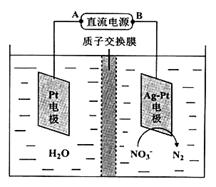
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。
 查看习题详情和答案>>
查看习题详情和答案>>