摘要:8.由短周期元素构成的甲.乙.丙.戊四种物质都具有 如图所示的结构单元.图中正四面体以外可能有部分未画出. 虚经一不表示化学健或分子间作用力.X.Y可以相同也可以 不同.已知: ①甲.乙是同一类晶体中各自结构单元.单质甲能与乙发生置换反应 ②丙.丁.戊三种粒子含有等量的电子数.其中丙.丁是同一类晶体中的分子或分子集团 ③常温下丁呈液态.能产生两种等电子数的粒子 ④戊是阳离子 (1)甲与乙发生置换反应的化学方程式是 . 当甲被破坏了1mol共价键.则参加反应的乙为 g. (2)写出液态丁产生两种等电子粒子的电离方程式 . (3)丙是目前重要的能源.丙和丁在催化.加热条件下得到两种可燃性的气体.其反应的化学方程式是 . (4)室温下.含有戊的盐溶液.其pH A.大于7 B.小于7 C.等于7 D.以上都有可能
网址:http://m.1010jiajiao.com/timu3_id_82008[举报]
 甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:
甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:(1)戊元素的原子结构示意图为


(2)A的电子式为


(3)工业上由F制备H的条件是
常压、催化剂(或V2O5)、500℃左右(高温)
常压、催化剂(或V2O5)、500℃左右(高温)
(4)反应(Ⅰ)的离子方程式为
2OH-+SO2═SO32-+H2O
2OH-+SO2═SO32-+H2O
.(5)反应(Ⅱ)的化学方程式为
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Cl2+2H2O=H2SO4+2HCl
. 甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水.
①若甲为块状固体,丙为可燃性气体,则丙分子内含有的化学键类型为
极性键或非极性键
极性键或非极性键
.(填离子键、极性键或非极性键)②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,则产物中具有漂白性的物质的化学式为
HClO
HClO
.(2)转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是
C+H2O(g)
CO+H2
| ||
C+H2O(g)
CO+H2
.
| ||
③从氧化还原的角度分析,上述①②两个反应中水的作用是相同的,请写出一个水的作用是相反的化学方程式
2F2+2H2O═4HF+O2↑
2F2+2H2O═4HF+O2↑
.④若甲是由N和O元素组成的气态物质,呈红棕色.将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应后溶液中铁元素的价态为
+2和+3
+2和+3
. 甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式
H-C≡C-H
H-C≡C-H
.(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象
产生大量白烟,黄绿色气体消失
产生大量白烟,黄绿色气体消失
②相应的反应化学方程式8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式
NCl3
NCl3
,反应方程式3Cl2+NH4Cl═NCl3+4HCl
3Cl2+NH4Cl═NCl3+4HCl
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
| ||
| △ |
| ||
| △ |
| ||
| △ |
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
| △ |
| ||
| △ |
| ||
| △ |
甲、乙、丙、丁、戊为五种短周期元素,且原子序数依次增大.甲与丁、丙与戊分别同主族,戊的原子最外层电子数比次外层少2个.甲与乙可以按照原子个数比3:1形成化合物A,且每个A分子中含有10个电子.请回答:
(1)戊的原子结构示意图是
 ,乙单质分子的电子式是
,乙单质分子的电子式是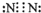
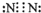 .
.
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示)
(3)甲与丁可形成一种离子化合物,该化合物与H2O反应得到强碱溶液和H2,则该反应中,氧化剂与还原剂的物质的量之比是
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成.X、Y、Z的稀溶液之间存在如下转化关系:
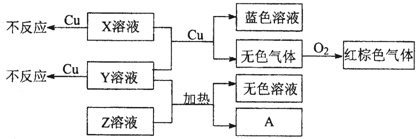
①Y、Z混合后加热得到A离子方程式是
②金属Cu与X、Y的混合溶液反应的离子方程式是
查看习题详情和答案>>
(1)戊的原子结构示意图是


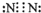
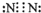
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示)
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.(3)甲与丁可形成一种离子化合物,该化合物与H2O反应得到强碱溶液和H2,则该反应中,氧化剂与还原剂的物质的量之比是
1:1
1:1
.(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成.X、Y、Z的稀溶液之间存在如下转化关系:

①Y、Z混合后加热得到A离子方程式是
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
;
| ||
②金属Cu与X、Y的混合溶液反应的离子方程式是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大.甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)甲元素的名称为
 .
.
(2)A的电子式为
 ;所含化学键类型为
;所含化学键类型为
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)
(4)反应(I)的化学方程式为
(5)反应(II)的离子方程式为
查看习题详情和答案>>

试回答:
(1)甲元素的名称为
氢
氢
,溴元素在周期表的位置第四周期ⅦA族
第四周期ⅦA族
丁元素的阴离子结构示意图为

(2)A的电子式为


离子键和共价键
离子键和共价键
.(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)
S2->O2->Na+
S2->O2->Na+
.(4)反应(I)的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(5)反应(II)的离子方程式为
SO2+Br2+2H2O=4H++SO42--+2Br-
SO2+Br2+2H2O=4H++SO42--+2Br-
.