网址:http://m.1010jiajiao.com/timu3_id_81998[举报]

(2)反应过程中甲中可能发生的反应为:__________(写化学反应方程式)。
(3)接入该仪器后,点燃酒精灯,反应开始一段时间后,在丁处 检验到某种无色无味气体,它是__________;由于甲中加入了单 质碳,使丁处产生气体的速率比不加入时快,这是因为____________。
(4)反应结束后,甲装置的试管中的溶液里存在的溶质是____________。
. 某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
(Ⅰ)制取氨气及喷泉现象的探究
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
3.喷泉是一种常见的自然现象。
(1)图1为化学教材中的喷泉实验装置。该生积极思考,只要满足烧瓶内压强与玻璃管水柱压强的和小于烧瓶外的压强就可以产生喷泉。于是他设计了图2和图3所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是__________。
A.Cu和稀盐酸 B.NaHCO3与NaOH溶液 C.MnO2与稀盐酸 D.Na2CO3与稀盐酸
②在图3锥形瓶中加入易挥发物质(如酒精),水槽中加入冷水后,再加入下列的物质足量,结果也产生了喷泉。水槽中后加入的物质可以是___________。
A.浓硫酸 B.食盐 C.生石灰 D.蔗糖
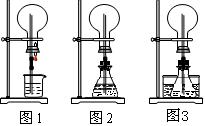
(2)城市中常见的人造喷泉及火山爆发的原理与上述___________(从“图1”或“图2”中选择)装置的原理相似。
(Ⅱ)该小组中某同学设计了下列所示的实验
装置(夹持及尾气处理装置未画出),探究氨气
的还原性:
|
|
|
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。

某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
①在周期表中Cu和Al位置比较接近,Al(OH)3具有两性,Cu(OH)2是否也有两性?
②通常情况下,+2价Fe不如十3价Fe稳定,十l价Cu也一定不如+2价Cu稳定吗?
③CuO有氧化性,能被H2、CO还原,CuO也能被NH3还原吗?
(I)为探究问题①,除Cu(OH)2外必须选用的试剂为______(填序号):
a、稀H2SO4 b、浓的NaOH溶液 c、浓氨水 (NH3.H2O)
(II)为探究问题②,进行如下实验:
(1)将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该反应的化学方程式为______.该反应说明:在高温条件下,十l价的Cu比十2价Cu更______(填“稳定”或“不稳定”).
(2)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,由此可知,在酸性溶液中,+1价Cu比+2价Cu更______(填“稳定”或“不稳定”).
(III)为解决问题③,他设计了如下实验(夹持装置未画):

装置B中NH3和CuO反应生成铜,同时生成一种无污染的气体,反应的化学方程式为______,说明CuO能够被NH3还原.装置C的作用:______.
查看习题详情和答案>>
 某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
(Ⅰ)制取氨气及喷泉现象的探究
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
3.喷泉是一种常见的自然现象。
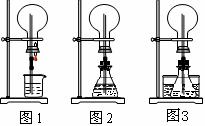
(1)图1为化学教材中的喷泉实验装置。该生积极思考,只要满足烧瓶内压强与玻璃管水柱压强的和小于烧瓶外的压强就可以产生喷泉。于是他设计了图2和图3所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是__________。
A.Cu和稀盐酸 B.NaHCO3与NaOH溶液 C.MnO2与稀盐酸 D.Na2CO3与稀盐酸
②在图3锥形瓶中加入易挥发物质(如酒精),水槽中加入冷水后,再加入下列的物质足量,结果也产生了喷泉。水槽中后加入的物质可以是___________。
A.浓硫酸 B.食盐 C.生石灰 D.蔗糖
(2)城市中常见的人造喷泉及火山爆发的原理与上述___________(从“图1”或“图2”中选择)装置的原理相似。
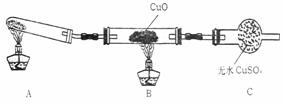 (Ⅱ)该小组中某同学设计了下列所示的实验
(Ⅱ)该小组中某同学设计了下列所示的实验
装置(夹持及尾气处理装置未画出),探究氨气
的还原性:
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
查看习题详情和答案>>(12分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变为浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| ④镁带与2mol/L盐酸反应 | (D)剧烈反应,产生可燃气体 |
| ⑤铝条与2mol/L盐酸反应 | (E)生成白色胶状沉淀,后来沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(1)实验目的: 研究同周期元素性质递变规律
(2)实验用品:
仪器: ①________②________③________④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4)实验结论:
金属性:________________ 非金属性: ________________
(5)写出⑥的离子方程式:_________________________________。
【解析】有试管夹,必然有试管。反应需要加热,需要酒精灯。滴加试剂,需要胶头滴管。镁和热水反应生成氢气和氢氧化镁,溶液显碱性。氯的非金属性强于硫的,所以氯气可以把硫置换出来。钠属于活泼的金属,和水反应剧烈。镁和铝均属于活泼的金属,和盐酸反应生成氢气,但镁的活泼性强于铝的,反应更剧烈。氢氧化铝是两性氢氧化物,能溶于强碱。
查看习题详情和答案>>