摘要:已知等边三角形纸片的边长为.为边上的点.过点作交于点.于点.过点作于点.把三角形纸片分别沿按图1所示方式折叠.点分别落在点..处.若点..在矩形内或其边上.且互不重合.此时我们称为“重叠三角形 . (1)若把三角形纸片放在等边三角形网格中(图中每个小三角形都是边长为1的等边三角形).点恰好落在网格图中的格点上.如图2所示.请直接写出此时重叠三角形的面积, (2)实验探究:设的长为.若重叠三角形存在.试用含的代数式表示重叠三角形的面积.并写出的取值范围(直接写出结果.备用图供实验.探究使用). 解:(1)重叠三角形的面积为 , (2)用含的代数式表示重叠三角形的面积为 ,的取值范围为 .
网址:http://m.1010jiajiao.com/timu3_id_8186[举报]
如图所示,已知等边△OAB的边长为a,以边AB上的高OA1为边,按逆时针方向作等边△OA1B1,A1B1与OB相交于点A2,若再以OA2为边按逆时针方向作等边△OA2B2,A2B2与OB1相交于点A3,按此作法进行下去,得到△OA3B3,△OA4B4,…,△OAnBn.

则△OA6B6的边长为 .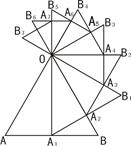 查看习题详情和答案>>
查看习题详情和答案>>

则△OA6B6的边长为 .
 查看习题详情和答案>>
查看习题详情和答案>>
 29、如图所示,河岸边分布甲、乙、丙、丁四座化工厂,环保人员为监测水质来到河边,观察到如下现象:b处出现红褐色浑浊,c处河水由浑浊变澄清,d处河水冒气泡.测得a处水样pH=12,M处水样pH=5.已知两个化工厂排放的废液中含下列物质中的各一种:Na2CO3、FeCl3、HCl和Ba(OH)2.请你帮助环保人员推断,丙厂排放的是
29、如图所示,河岸边分布甲、乙、丙、丁四座化工厂,环保人员为监测水质来到河边,观察到如下现象:b处出现红褐色浑浊,c处河水由浑浊变澄清,d处河水冒气泡.测得a处水样pH=12,M处水样pH=5.已知两个化工厂排放的废液中含下列物质中的各一种:Na2CO3、FeCl3、HCl和Ba(OH)2.请你帮助环保人员推断,丙厂排放的是HCl
,丁厂排放的是Na2CO3
,M处一定不含有的阴离子是OH-和CO3 2-
请写出:
b处生成沉淀的化学方程式
3Ba(OH)2+FeCl3=Fe(OH)3↓+BaCl2
c处河水由浑浊变澄清的化学方程式
Fe(OH)3+3HCl=FeCl3+2H2O
.(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
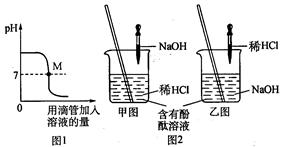
(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
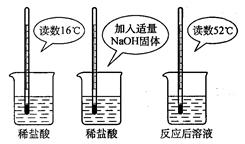
根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
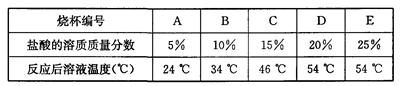
实验结论:影响该中和反应放出热量多少的因素是_______。

(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:

根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:

实验结论:影响该中和反应放出热量多少的因素是_______。

