摘要:3.已知反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O 加热 450°C 催化剂 MnO2+4HCl(浓)===MnCl2+Cl2+2H2O O2+4HCl(浓)====2Cl2+2H2O 则氧化剂KMnO4 MnO2 O2的氧化能力由强到弱的顺序是
网址:http://m.1010jiajiao.com/timu3_id_81748[举报]
已知反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 现有15.8g的KMnO4与足量的浓HCl反应
1、 标准状况下,生成多少升氯气?
2、 被氧化的HCl的物质的量是多少?
查看习题详情和答案>>
1、 标准状况下,生成多少升氯气?
2、 被氧化的HCl的物质的量是多少?
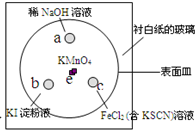 (2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.已知反应中有关物质的转化过程为:
KMnO4→MnCl2;
HCl→Cl2
(1)e 处的化学反应方程式为
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
该反应中氧化剂与还原剂的物质的量之比为_1:5
1:5
,电子转移的数目为10
10
.(2)b处的实验现象为
溶液变蓝色
溶液变蓝色
,c处的实验现象为溶液变红色
溶液变红色
.(3)a处的反应方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)通过该实验可比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是
KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
.(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是
 .
.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为

(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
查看习题详情和答案>>


②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为
分解
分解
反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.写出有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
,其中水为氧化
氧化
剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
①⑥
①⑥
(填序号,下同);H2O被氧化的是③
③
,H2O被还原的是④
④
,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是②⑤
②⑤
.(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
+7
+7
价变为+2
+2
价,被还原
还原
;Cl
Cl
元素的原子失去电子,被氧化
氧化
;若参加反应的HCl是73g,则被氧化的HCl是45.625
45.625
g.(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
D
D
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂的主要成分,它们都能与水或酸反应产生有毒气体PH3,PH3具有较强的还原性,能在空气中自燃.我国粮食卫生标准规定,粮食中磷化物(以PH3计)含量≤0.05mg?kg-1.现用如下装置测定粮食中残留磷化物含量.
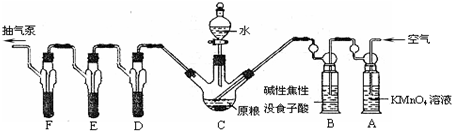
(已知:5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O)C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3 mol?L-1的KMnO4的溶液(H2SO4酸化).
(1)检查上述装置气密性的方法是
(2)实验过程中,用抽气泵抽气的目的是
(3)A中盛装KMnO4溶液是为除去空气中可能含有的
(4)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4 mol?L-1 Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为
mg/kg.(已知:5Na2SO3+2KMnO4+3H2SO4=K2SO4+5Na2SO4+2MnSO4+3H2O)
查看习题详情和答案>>

(已知:5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O)C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3 mol?L-1的KMnO4的溶液(H2SO4酸化).
(1)检查上述装置气密性的方法是
打开抽气泵抽气,观察各装置中是否有气泡产生
打开抽气泵抽气,观察各装置中是否有气泡产生
.(2)实验过程中,用抽气泵抽气的目的是
保证生成的PH3进入D、E、F,被酸性KMnO4溶液全部吸收
保证生成的PH3进入D、E、F,被酸性KMnO4溶液全部吸收
.(3)A中盛装KMnO4溶液是为除去空气中可能含有的
还原性气体
还原性气体
;B中盛装碱性焦性没食子酸溶液的作用是除去空气中的O2
除去空气中的O2
;如去除B装置,则实验中测得的PH3含量将偏低
偏低
.(4)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4 mol?L-1 Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为
0.085g/kg
0.085g/kg
mg/kg.(已知:5Na2SO3+2KMnO4+3H2SO4=K2SO4+5Na2SO4+2MnSO4+3H2O)
实验室可选用图15-39中的部分或全部装置测定由SO2、CH4、CO2和H2所组成的混合气体中某种成分的质量分数。设气体通过每种装置时都能完全反应。?
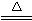 ?
?
图15-39
已知:2C![]() H
H![]() +(4x+y)CuO
+(4x+y)CuO![]() 2xCO2+(4x+y)Cu+yH2O?
2xCO2+(4x+y)Cu+yH2O?
(1)若只测定SO2气体,必须选用的装置是: (填装置序号,下同);若只测定混合气体中的CO2,必须选用的装置有 。?
(2)若四种气体分别依次通过③④①②⑤和③④⑤②①,是否都可测量出四种气体的质量分数? (填“能”或“不能”)。?
(3)若混合气体总质量为M g,分别依次通过③④①②⑤,实验②装置减少M1 g,⑤装置增重M2 g,则原混合气体中CH4的质量分数w (CH4) 。?
(4)若将混合气体中甲烷换成乙烯,其他不变(已知:3CH2![]() CH2+2KMnO4(稀)+4H2O
CH2+2KMnO4(稀)+4H2O![]() 3CH2OH—CH2OH+2KOH+2MnO2↓),设每次原混合气体取样均为M g,只选用装置中的③④⑤,能否测定混合气体中SO2的质量分数? (填“能”或“不能”)。如果能,请简要写出你的设计方案和结果:? ? 。??
3CH2OH—CH2OH+2KOH+2MnO2↓),设每次原混合气体取样均为M g,只选用装置中的③④⑤,能否测定混合气体中SO2的质量分数? (填“能”或“不能”)。如果能,请简要写出你的设计方案和结果:? ? 。??