摘要:4.空气吹出法工艺.是目前“海水提溴 的最主要方法之一.其工艺流 程如下: (1)溴在元素周期表中位于 周期. 族. (2)步骤①中用硫酸酸化可提高Cl2的利用率.其原因是 . (3)步骤④的离子方程式: . (4)步骤⑥的蒸馏过程中.溴出口温度要控制在80℃-90℃.温度过高或过低都不利 于生产.请解释原因: . (5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物.可利用它们的相对密度相差较大 的特点进行分离.分离仪器的名称是 .分离时液溴从分离器的 (填 “上口 或“下口 )排出. (6)不直接用含溴的海水进行蒸馏得到液溴.而要经过“空气吹出.SO2吸收.氯化 的原因是 . 解析:变化过程为: 答案:(1)第四 ⅦA (2)酸化可防止Cl2.Br2与水反应 (3)Br2+SO2+2H2O===4H++2Br-+SO- (4)温度过高.大量水蒸气随水排出去.溴气中水分增加,温度过低.溴不能完全蒸 出.吸收率低 (5)分液漏斗 下口 (6)氯化后的海水虽然含有溴单质.但浓度低.如果直接蒸馏原料.产品成本高“空 气吹出.SO2吸收.氯化 的过程实际上是一个Br2的浓缩过程
网址:http://m.1010jiajiao.com/timu3_id_81284[举报]
(2009?黄浦区二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
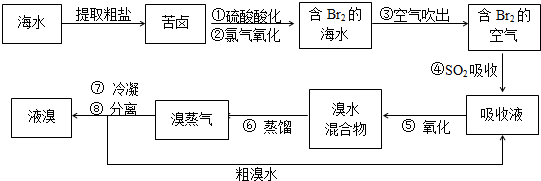
(1)溴在元素周期表中位于
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是
(3)步骤④的离子方程式:
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:
(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是
查看习题详情和答案>>

(1)溴在元素周期表中位于
第四
第四
周期,VIIA
VIIA
族.(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是
酸化可抑制Cl2、Br2与水反应
酸化可抑制Cl2、Br2与水反应
.(3)步骤④的离子方程式:
Br2+SO2+2H2O=4H++2Br-+SO42-
Br2+SO2+2H2O=4H++2Br-+SO42-
.(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气随水排出去,溴气中水分增加;温度过低,溴不能完全蒸出,吸收率低
温度过高,大量水蒸气随水排出去,溴气中水分增加;温度过低,溴不能完全蒸出,吸收率低
.(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
分液漏斗
分液漏斗
,分离时液溴从分离器的下口
下口
(填“上口”或“下口”)排出.(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是
氧化后的海水虽然含有溴单质,但浓度低;如果直接蒸馏原料,产品成本高
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
氧化后的海水虽然含有溴单质,但浓度低;如果直接蒸馏原料,产品成本高
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
.;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.以海水提盐后得到的苦卤为原料,提溴的工艺流程如下: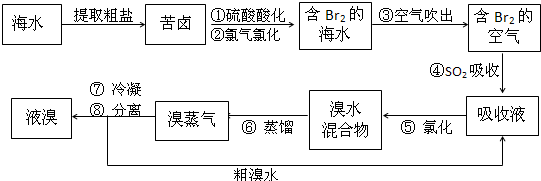
回答下列问题:
(1)步骤②的离子方程式为
(2)⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,理由是
(3)步骤②后,已经得到了含溴的海水,为什么不能直接进行蒸馏得到液溴,而要经过一系列后续操作,原因是
查看习题详情和答案>>

回答下列问题:
(1)步骤②的离子方程式为
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
、步骤④的离子方程式为Br2+SO2+2H2O═4H++SO42-+2Br-
Br2+SO2+2H2O═4H++SO42-+2Br-
.(2)⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,理由是
理由是温度过高会蒸出大量水,过低不便于溴的蒸出
理由是温度过高会蒸出大量水,过低不便于溴的蒸出
.(3)步骤②后,已经得到了含溴的海水,为什么不能直接进行蒸馏得到液溴,而要经过一系列后续操作,原因是
原因是溴的浓度太低、蒸馏效率低成本太高
原因是溴的浓度太低、蒸馏效率低成本太高
.(2011?南京模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于
(2)步骤④的离子方程式:
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.若在实验室分离上述混合物的分离仪器的名称是
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
查看习题详情和答案>>

(1)溴在周期表中位于
第四
第四
周期,ⅦA
ⅦA
族.(2)步骤④的离子方程式:
Br2+SO2+2H2O=4H++2Br-+SO42-
Br2+SO2+2H2O=4H++2Br-+SO42-
.(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
.(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.若在实验室分离上述混合物的分离仪器的名称是
分液漏斗
分液漏斗
,分离时液溴从分离器的下口
下口
(填“上口”或“下口”)排出.(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
.空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下,其中不正确的是( )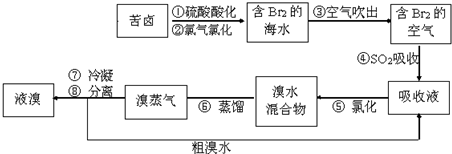

| A、步骤①中用硫酸酸化可防止Cl2、Br2与水反应 | B、步骤④的离子方程式Br2+SO2+H2O=2H++2Br-+SO42- | C、溴在周期表中位于4周期VIIA族 | D、步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗 |
(2012?邯郸一模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下: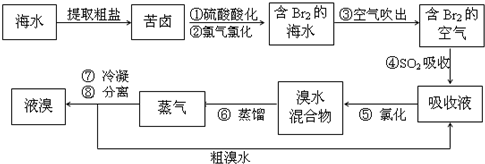
(1)溴在周期表中位于
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是
(3)步骤④利用了SO2的还原性,反应的离子方程式为
(4)步骤⑥的蒸馏过程中,温度应控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
查看习题详情和答案>>

(1)溴在周期表中位于
4
4
周期VIIA
VIIA
族.(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是
酸化可抑制Cl2、Br2与水反应
酸化可抑制Cl2、Br2与水反应
.(3)步骤④利用了SO2的还原性,反应的离子方程式为
Br2+SO2+2H2O=4H++2Br-+SO42-
Br2+SO2+2H2O=4H++2Br-+SO42-
.(4)步骤⑥的蒸馏过程中,温度应控制在80-90℃.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
.(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
分液漏斗
分液漏斗
.(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
.